时间:2017-09-23 23:45:53
1、选择题 常温下,向100 mL 0.1 mol·L-1 H2A(二元酸)溶液中逐滴加入0.2 mol·L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列有关说法正确的是( )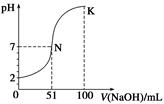
A.H2A为二元强酸
B.N点对应溶液有:c(Na+)=c(A2-)+c(HA-)
C.K点对应溶液中离子浓度由大到小的顺序为c(A2-)>c(Na+)>c(OH-)>c(H+)
D.K点时加水稀释溶液,c(H+)增大
参考答案:D
本题解析:由于0.1 mol·L-1 H2A溶液pH=2,所以该酸为二元弱酸,A错误;B项,根据电荷守恒,其关系式应为c(Na+)=2c(A2-)+c(HA-),错误;C项,K点正好生成Na2A溶液,c(Na+)>c(A2-)>c(OH-)>c(H+),错误;D项,K点溶液呈碱性,加水稀释
c(OH-)减小,c(H+)增大。
本题难度:一般
2、选择题 未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属于新能源的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能
A.①②③④
B.⑤⑥⑦⑧
C.③④⑤⑥
D.除①②外
参考答案:B
本题解析:新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生,根据这些特征进行判断,石油、天然气、煤属于化石能源,短时间内不可形成,是不可再生能源;太阳能、燃料电池、风能、氢能是清洁能源且可以再生,是新能源的范畴选B。
考点:考查新能源的判断。
本题难度:简单
3、选择题 25℃、1.01×105 Pa时,下列哪个反应放出的热量能表示乙炔的燃烧热 ( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g)
B.C2H2(g)+ O2(g)===2CO2(g)+H2O(l)
O2(g)===2CO2(g)+H2O(l)
C.C2H2(g)+ O2(g)===2CO(g)+H2O(g)
O2(g)===2CO(g)+H2O(g)
D.C2H2(g)+ O2(g)===2CO(g)+H2O(l)
O2(g)===2CO(g)+H2O(l)
参考答案:B
本题解析:
试题解析:燃烧热的条件是在25℃、1.01×105Pa下,必须是1mol物质完全燃烧并且生成的物质为最稳当的氧化物,燃烧热的热化学方式的计量系数必须是1,常温下水是液态,故B项正确。
考点:燃烧热
本题难度:一般
4、选择题 pH=10的NaOH和pH=12的Ba(OH)2等体积混合后,溶液的pH值为
A.11.7
B.10.3
C.11.4
D.11.0
参考答案:A
本题解析:
【错解分析】(1)已知两种溶液的pH值,求混合后溶液的pH值,往往从两种酸入手。一是pH值与氢离子浓度相互换算较为简单、直观,二是计算推断与事实相符不易错。但也易形成思维定势,遇到任何两种溶液混合,先求混合液的[H+],再求其pH值。如:两种碱溶液等体积混合,由于将氢离子视为溶质,按下式求混合液的氢离子浓度:
pH=10的NaOH,其[H+]=1×10-10mol·L-1;
pH=12的Ba(OH)2,其[H+]=1×10-12mol·L-1;
=50.5×10-12mol·L-1
进而计算出混合液的pH值为10.3,得出错误选项B的结论。
实际上碱溶液的溶质应是氢氧根离子,其浓度随溶液体积变化而变化。而碱溶液中的氢离子是由水电离生成,其浓度只随上述溶质氢氧根离子浓度变化而变化,两者乘积为水的离子积。两种碱溶液混合,其溶质也应是氢氧根离子。计算混合液的氢氧根离子浓度,再由水的离子积计算氢离子浓度,进而计算混合液的pH值。
(2)由溶液pH值求出的氢离子浓度,是溶液中已电离的氢离子浓度,对于多元强酸来说,它应是酸的物质的量浓度和其元数的乘积。由于上述关系不清,常常误将pH值求出的氢离子浓度再与酸的元数相乘视为其氢离子浓度。因而得出错误选项C。对于多元强碱也易发生类似错误。
【正解】本题的正确解法为:
pH=10[H+]=1×10-10mol·L-1,[OH-]=1×10-4mol·L-1
pH=12[H+]=1×10-12mol·L-1,[OH-]=1×10-2mol·L-1
=50.5×10-4mol·L-1
=2×10-12mol·L-1
pH=11.7
本题难度:简单
5、填空题 (6分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)终点的判断:溶液由_____________________________________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(? )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用
盐酸溶液的体积为_________ml。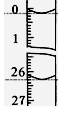
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
参考答案:(1)浅红色变为无色且半分钟内不恢复 (2)D ? (3) 26.10
(4)V=26.20 ml,(第二次偏差太大,舍去)
c(NaOH)=0.1000 mol/L×26.20 mL/25.00 mL=0.1048 mol/L
本题解析:略
本题难度:一般