时间:2017-09-23 23:37:58
1、简答题 A、B、C、D四种元素,A元素所处的周期数,主族序数,原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称______,B在周期表中的位置______,
(2)A、B形成的化合物的电子式______;
(3)C的元素符号______,C的最高价氧化物的化学式______;
(4)D的最高价氧化物的水化物中含有______键.
(5)用电子式表示D2C的形成过程:______.
参考答案:A元素所处的周期数,主族序数,原子序数均相等,则A为H;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为N;C元素原子的最外层电子数比次外层少2个,C有3个电子层,最外层电子数为6,则C为S;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D在第四周期第ⅠA族,即D为K,
(1)B为N,其名称为氮,原子结构中有2个电子层,最外层电子数为5,故答案为:氮;第二周期第VA族;?
(2)A、B形成的化合物为NH3,其电子式为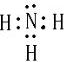
,故答案为: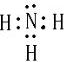
;
(3)C的元素符号为S,最高价为+6价,则最高价氧化物为SO3,故答案为:S;SO3;?
(4)D的最高价氧化物的水化物为KOH,含有离子键、共价键,故答案为:离子键、共价键;
(5)K最外层1个电子,S最外层6个电子,则用电子式表示K2S的形成过程为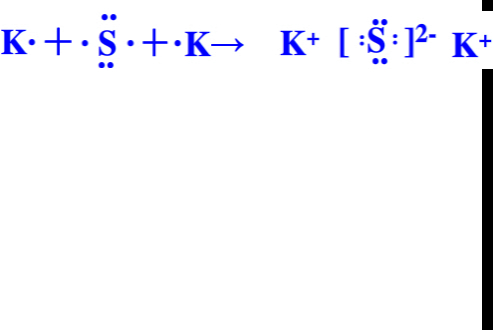
,
故答案为: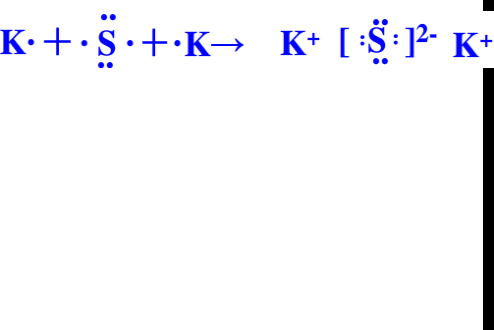
.
本题解析:
本题难度:一般
2、填空题 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满。
根据以上信息回答下列问题:
(1)写出D原子核外电子排布式:____________________________________________。
(2)A、B、C、D的第一电离能由小到大的顺序为________________________________(用元素符号表示)。
(3)B的氯化物的熔点比D的氯化物的熔点________(填“高”或“低”);理由是_______________________________________________________。
(4)E的最高价氧化物分子的空间构型是________,是________(填“极性”或“非极性”)分子。
(5)E、F形成的某种化合物有如图所示的晶体结构:该化合物化学式为________;E原子配位数为________________________________________________。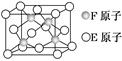
参考答案:(1)1s22s22p63s23p2 (2)Na<Al<Si<N
(3)高 NaCl是离子晶体,SiCl4是分子晶体
(4)平面正三角形 非极性 (5)ZnS 4
本题解析:根据信息提示可知,元素A的原子核外电子排布为1s22s22p3,故A为N;E元素原子核外电子排布为1s22s22p63s23p4,故E为S;由C元素在地壳中的含量可知,C为Al;根据B2E为离子晶体,且B元素原子序数介于7与13之间,故B为Na;根据D单质的熔点特点可知,D为Si;F为Zn。(1)Si为第14号元素,核外电子排布式为1s22s22p63s23p2。(2)同周期元素第一电离能从左到右呈现逐渐增大的趋势,故第一电离能:Na<Al<Si<P,同主族元素从上到下则呈现逐渐减小的趋势,故第一电离能:P<N,因此第一电离能:Na<Al<Si<N。(3)NaCl为离子晶体,而SiCl4为分子晶体,故熔点:NaCl>SiCl4。(4)SO3分子的空间构型为平面正三角形,SO3具有很好的对称性,是非极性分子。(5)S原子居于晶胞的8个顶点和6个面心,故一个晶胞中含有的S原子数为8×1/8+6×1/2=4,Zn原子居于晶胞内部,Zn原子个数为4,故该化合物的化学式为ZnS;分析该晶胞结构可知,S原子的配位数为4。
本题难度:一般
3、选择题 下列说法不正确的是
[? ]
A.共价化合物和离子化合物中,一定都含有非金属元素
B.一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
C.全部由非金属构成的化合物一定不存在离子键
D.共价化合物都是由分子构成的,而离子化合物中一般不存在单个分子
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列表达方式错误的是( )
A.CO2的分子模型示意图:
B.HClO的路易斯结构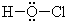
C.sp3杂化道图: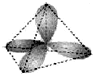
D.π电子云图:
参考答案:AB
本题解析:
本题难度:简单
5、选择题 关于下列说法正确的是(? )
A.加热氯化铵与固化碘过程中发生的都是升华
B.氢键的存在主要影响物质的物理性质,如熔沸点和在水中的溶解度
C.水分子相当稳定是因为水分子间存在很强的分子间作用力
D.直接由原子构成的晶体必然是原子晶体
参考答案:B
本题解析:加热氯化铵分解生成氨气和氯化氢,属于化学变化,而升华是物理变化,A不正确;氢键不是化学键,一般影响物质的物理性质,B正确;水分子的稳定性和水分子中的共价键有关系,分子间作用力不能影响物质的稳定性,一般影响的是物质的物理性质,C不正确。直接由原子构成的晶体也可以是分子晶体,例如稀有气体,D不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,侧重对学生解题能力的培养。该题的关键是利用举例排除逐一筛选得出正确结论的方法,有利于激发学生的学习兴趣,提高学生的应试能力和严谨的逻辑推理能力。
本题难度:一般