时间:2017-09-23 23:19:16
1、实验题 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)?铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
①?配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
②?加入锌粉的目的是________。
③?写出步骤三中发生反应的离子方程式________。
④?实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2)?结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
参考答案:
本题解析:略
本题难度:一般
2、实验题 ;使用中学常用实验器材设计一个实验,证实Ba( OH)2和H2SO4在溶液中的反应是离子反应,要求写出有关的实验原理、过程、现象。
(1)实验原理:___;
(2)实验过程:____;
(3)实验现象:____。
参考答案:(1) Ba(OH)2+H2SO4=BaSO4↓+2H2O
(2)将石墨棒、导线、灯泡、烧杯中盛有的Ba( OH)2溶液组成闭合电路,并固定滴定管(盛H2SO4)于铁架台上,再向Ba(OH)2溶液中滴加同浓度的H2SO4溶液直至过量
(3)电灯明亮,逐渐变暗直至熄灭,后又逐渐变亮
本题解析:
本题难度:一般
3、填空题 某同学利用如图1所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.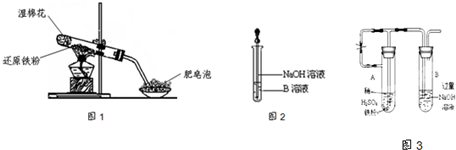
已知:①FeO+2H+=Fe2++H2O②Fe2O3+6H+=2Fe3++3H2O?③Fe3O4+8H+=Fe2++2Fe3++4H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______.
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)______,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)______.
A.一定有Fe3O4,可能有Fe?B.只有Fe(OH)3C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有FeE.只有Fe3O4
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是______(用离子方程式表示).
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式______.
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有______性.由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是______,并且配制含Fe2+的盐溶液时应加入少量______.
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用图3所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应.获得不含O2的蒸馏水的方法是______.反应开始时,打开止水夹的目的是______;
一段时间后,关闭止水夹,在试管______(填“A”或“B”)中观察到白色的Fe(OH)2.
参考答案:(1)铁在高温下与水反应,铁表现为还原性,水表现出氧化性,生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)??高温?.?Fe3O4+4H2,
故答案为:3Fe+4H2O(g)??高温?.?Fe3O4+4H2;?
(2)铁和水蒸气反应,产物为四氧化三铁和氢气,待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B,一定发生Fe3O4+8H+=Fe2++2Fe3++4H2O,取少量溶液B滴加KSCN溶液,若溶液变红色Fe3++3SCN-?Fe(SCN)3,则说明所得溶液中存在的阳离子是一定有Fe3+,一定有Fe3O4,可能有过量的铁;若溶液未变红色,可能含有过量的铁,将三价铁离子全部转化成二价铁离子,Fe+2Fe3+═3Fe2+,故答案为:A;C;
(3)铁和水蒸气反应,产物为四氧化三铁和氢气,可能有过量的铁,固体物质溶于稀硫酸得溶液B,溶液中过量的铁可能将三价铁离子全部转化成二价铁离子,Fe+2Fe3+═3Fe2+,Fe2+与KSCN溶液不反应,所以,该同学按上述实验方案进行了实验,结果溶液未变红色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,说明含有Fe2+离子,综上分析可知,白色沉淀为氢氧化亚铁,红褐色沉淀为氢氧化铁,所以反应为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)Fe2+溶液因为水解和还原性而不易保存,可以加入酸抑制其水解,加入还原性铁(铁钉)防止其被氧化,故答案为:还原;Fe2+易被空气中的氧气氧化而变质;铁粉;
(6)加热时气体的溶解度降低,所以,除去蒸馏水中溶解的O2常采用加热煮沸的方法;利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,使A、B充满还原性气体氢气,可排除试管中的氧气,防止Fe(OH)2?被空气中氧气氧化,一段时间后,关闭止水夹,试管A中生成的FeSO4溶液压到试管B,与试管B中的NaOH溶液反应,生成Fe(OH)2沉淀,在试管B中观察到白色的Fe(OH)2,
故答案为:把蒸馏水煮沸;利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,防止Fe(OH)2?被空气中氧气氧化;B.
本题解析:
本题难度:一般
4、实验题 课题式课堂教学是研究性学习的一种方式,其基本教学模式为
图1是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置。 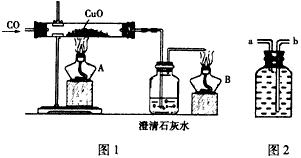
(1)实验时应先点燃______处(填“A”或“B”)的酒精灯。
(2)硬质试管中反应的化学方程式为______________________。
(3)乙同学认为甲同学设计的装置有待优化,如尾气可先储存在瓶内,然后再处理。
图2是他设计的贮气瓶,尾气应从______(选填“a”或“b”)口通入(其他装置略)
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水, 以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要:_______,理由是_____________________。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?______________。
参考答案:(1)B
(2)CuO+CO Cu+CO2
Cu+CO2
(3)a
(4)不必要;在酒精灯A点燃前,CO已通过了澄清石灰水
(5)先通过碱石灰除去CO2后再通入装置(通过NaOH溶液亦可)
本题解析:
本题难度:一般
5、简答题 有机物间的反应很复杂,往往有很多副反应发生;如乙醇与浓硫酸的混合溶液在不同温度下发生的反应类型不同,再如卤代烃(CaHbX,X指代Cl、Br、I等)在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物;因此在有机化学学习中知道各种有机反应的类型和对应反应发生所需条件是非常重要的.试回答下列问题:
(1)结合目前所学,试总结有机物在浓硫酸加热条件下可发生有机反应的类型有______;
(2)卤代烃①在NaOH水溶液加热条件下发生的反应类型是取代反应,②在NaOH醇溶液加热条件下发生的反应类型是消去反应.现要证明某卤代烃(CaHbX,X指代Cl、Br、I等)中存在何种卤素,你选择上述两条件中的哪一条(填序号)?并说明你这样选的理由:______.
(3)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______,检验的方法是______(需说明:所用的试剂、简单的实验操作及预测产生的实验现象).
参考答案:(1)有机物在浓硫酸加热条件下可发生有机反应有,苯的硝化反应,磺化反应,乙醇的消去反应、分子间脱水反应、酯化反应等,
故答案为:取代(酯化、硝化)反应、消去反应;
(2)检验卤代烃中的卤素元素的存在,需要先把卤代烃水解,使卤原子变化为卤素离子,选择①,因为不是所有的卤代烃都能发生消去反应,
故答案为:选择①,因为所有的卤代烃都能在该条件下水解,而只有与卤素原子相连的碳的邻碳上有氢的卤代烃才能在NaOH醇溶液加热条件下发生反应;
(3)验证卤代烃溴乙烷在强碱的醇溶液中发生消去反应,生成乙烯、溴化钠和水,和卤代烃在强碱的水溶液中加热生成物比较可知,都含有溴化钠,所以需要验证乙烯的存在,利用乙烯的加成反应,乙烯通入溴水中 褪色证明发生的是消去反应,
故答案为:乙烯的存在;将溴乙烷在NaOH乙醇溶液中共热产生的气体通入盛有溴水的试管,若溴水褪色,则说明发生了消去反应.
本题解析:
本题难度:一般