时间:2017-09-23 23:02:14
1、选择题 氢氟酸(HF)是一种弱酸。25℃时,向20mL0.1mol/L氢氟酸中加入VmL 0.1mol/LNaOH溶液充分反应。已知:
HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H=-67.7kJ/mol
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
根据题意,下列判断或结论正确的是
A.氢氟酸的电离过程是吸热的
B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol/L
C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-)
D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)
参考答案:C
本题解析:A、根据盖斯定律,将上式相减可得氢氟酸的电离方程式,反应热为-67.7kJ/mol-(-57.3kJ/mol)=-10.4kJ/mol<0,所以氢氟酸的电离过程是放热的,错误;B、当V=20时,氢氟酸与氢氧化钠溶液恰好完全反应生成NaF,溶液体积为40mL,因为氢氟酸是弱酸,所以氟离子会发生水解,使溶液成碱性,则c(F-)<c(Na+)=0.05mol/L,错误;C、因为恰好完全反应时溶液呈碱性,则当V<20时,溶液可能呈中性,溶液中离子浓度关系可能为:c(Na+)=c(F-)> c(OH-)= c(H+),正确;D、当V>20时,溶液为NaF和NaOH的混合液,溶液中的离子浓度可能是c(Na+)>c(F-)>c(OH-)>c(H+),也可能是c(Na+)>c(OH-)>c(F-)>c(H+),错误,答案选C。
考点:考查盖斯定律的应用,溶液中离子浓度大小关系的判断
本题难度:困难
2、选择题 下列各组中的反应,属于同一反应类型的是( )
A.乙醇和氧气制乙醛;苯和氢气制环已烷
B.乙烯使溴水褪色;苯的硝化反应
C.葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯
D.乙烷和氯气制氯乙烷;乙醇和乙酸制乙酸乙酯
参考答案:D
本题解析:
本题难度:一般
3、选择题 把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
A.c (CH3COO-)="c" (Na+)
B.c (OH-)>c (H+)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.01mol/L
参考答案:D
本题解析:0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后,所得溶液中含有得溶质是醋酸和醋酸钠,且二者得物质的量是相等得。由于不能确定溶液得酸碱性,因此选项A、B、C都是不一定正确得。根据物料守恒可知,选项D正确,答案选D。
考点:考查溶液中离子浓度大小比较
点评:比较溶液中离子浓度时,一般遵循几个关系式,即电荷守恒定律、物料守恒和质子守恒。另外在水解应用时,,还需要具体问题具体分析,不可随意套用。
本题难度:困难
4、选择题 下列物质间的反应中,属于消去反应的是( )
A.苯与Fe、Br2混合
B.氯乙烷和NaOH溶液共热
C.溴乙烷和NaOH的乙醇溶液共热
D.乙烯和溴水反应
参考答案:A、苯与Fe、Br2混合会发生取代反应生成溴苯,故A不选;
B、氯乙烷和NaOH溶液共热会发生取代反应生成乙醇,故B不选;
C、溴乙烷和NaOH的乙醇溶液共热会发生消去反应生成乙烯,故C选;
D、乙烯和溴水之间会发生加成反应生成1,2-二溴乙烷,故D不选.
故选C.
本题解析:
本题难度:一般
5、填空题 (14分)完成下列各题:(1).在 时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);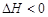 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为 N2的转化率为
②在 时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
a 大于0.4mol b 等于0.4mol c 小于0.4mol
③下图是在 时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在
时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在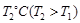 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。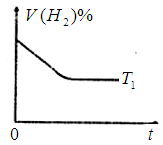
(2).已知:Al3 +与HCO3
参考答案:
本题解析:
本题难度:困难