时间:2017-09-23 23:00:53
1、填空题 (7分)(1)室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于?
(2)室温时,将0.1 mol/L盐酸和0.07mol/L氢氧化钡溶液1:5(体积比)混合后,该混合溶液的pH=_______
(3)某温度时,0.1 mol·L-1NaOH溶液的pH=12。该温度下,10体积pH=a的某强酸与1体积pH=b的某强碱混合后,溶液呈中性,则a和b满足的关系____________________
参考答案: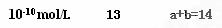
本题解析:略
本题难度:一般
2、填空题 已知下列热化学方程式:
①2H2(g) +O2(g)=2H2O(l) ΔH=" -" 570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g) ΔH=" -" 483.6 kJ·mol-1
③H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH= --114.6kJ·mol-1
回答下列问题:
H2的燃烧热为 ;反应③的中和热为 。
参考答案:(1)285 kJ·mol-1;57.3kJ·mol-1
本题解析:略
本题难度:一般
3、选择题 常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
C.pH=4的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-)
D.将pH=6的H2SO4稀释1000倍后,c(H+)="2" c(SO42-)
参考答案:C
本题解析:某物质的水溶液呈酸性,该物质可能是酸或强酸弱碱盐,也可能是Cl2、NO2、SO2、CO2等物质与水反应后,溶液呈酸性,A错误;同浓度CaCl2和NaCl溶液中Cl-浓度前者大,所以氯化银在氯化钠溶液中溶解度大,B错误;醋酸和醋酸钠混合溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液pH=4说明呈酸性,c(H+)>c(OH-),所以c(CH3COO-)>c(Na+),C正确;pH=6的硫酸中c(SO42-)=5×10-7mol/L,稀释1000倍后,c(H+)≈10-7mol/L,c(SO42-)=5×10-10mol/L,D错误。
点评:本题易误选D,硫酸溶液无论怎样稀释,不可能变成碱性溶液,只能无限接近中性溶液,所以不能认为pH=6的硫酸稀释1000倍后pH=9。
本题难度:简单
4、选择题 我们的生活离不开能源。下列属于绿色能源的
A.天然气
B.太阳能
C.石油
D.煤
参考答案:B
本题解析:石油、煤、天然气均为化石能源。而太阳能无污染、环保,属绿色能源
本题难度:简单
5、选择题 能使水的电离平衡右移,且水溶液显碱性的离子是(? )
A.H+
B.OH-
C.Al3+
D.HCO3-
参考答案:D
本题解析:H+、OH-均抑制水的电离;Al3+、H2O3-均促进水的电离,且HCO3-水解溶液呈弱碱性。
本题难度:一般