时间:2017-09-23 22:54:49
1、选择题 在容积可变的密闭容器中,2mo1 N2和8mo1 H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于( )
A.5%
B.10%
C.15%
D.20%
参考答案:达到平衡时,H2的转化率为25%,则转化的氢气的物质的量为8mol×25%=2mol,则
容积可变的密闭容器中,发生N2+3H2?一定条件?.?2NH3,
?开始? 2? 8? 0
?转化? 23? 2?43
?平衡(2-23) 6? 43
则平衡时的氮气的体积分数为2-23(2-23)+6+43×100%≈15%,
故选C.
本题解析:
本题难度:一般
2、填空题 298 K时,合成氨反应:N2(g)+3H2(g) 2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________
2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________
参考答案:小于(2分) N2和H2的反应是可逆反应,1 mol N2和3 mol H2充分反应的最终结果是达到最大限度(即达到化学平衡状态),因此生成的NH3一定小于2 mol,放出的热量总是小于理论计算值(4分)
本题解析:注意分析“生成2 mol NH3”与“1 mol N2(g)和3 mol H2(g)充分反应”,二者生成NH3的量的多少。
本题难度:一般
3、填空题 一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g) SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变 91eXaM.org化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
参考答案:(1)bcd
(2)a=1.60(或b=0.80),说明在一定条件下,t1~t2时各组分的浓度(或物质的量)均已不再发生改变,则t1时反应已经达到化学平衡状态
(3)ade
本题解析:(2)0~t1 min,反应消耗的SiF4为0.40 mol,根据已知反应可确定消耗的H2O为0.80 mol,故a=1.60 mol,t2 min时,H2O仍为1.60 mol,故b=0.80 mol。由此可判断t1时该反应已经达到化学平衡状态。
本题难度:一般
4、选择题 下列各图是温度T(或压强P)对f反应2A(s) + 2B(g) 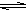 ?2C(g) + D(g)?△H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
?2C(g) + D(g)?△H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是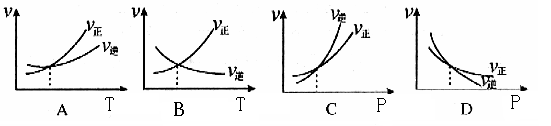
参考答案:AC
本题解析:升高温度,不管吸热放应还是放热反应,正逆速率均增大,且升高温度,平衡正向移动;
加压,体积缩小,浓度变大,正逆反应速率均增大,,且加压平衡逆向移动。
本题难度:简单
5、简答题 (14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g)?△H 1 = +489.0 kJ·mol-1
?②C(石墨) +CO2(g) = 2CO(g)?△H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为?。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g)?△H
CH3OH(g) +H2O(g)?△H
①该反应的平衡常数表达式为K=???。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH?0 (填“>”、“<”或“=”)。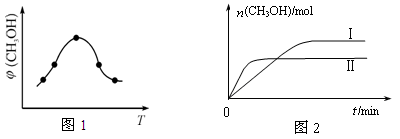
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ?KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为?。
当氨碳比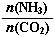 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为:?。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为:?。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为?。
参考答案:(1)Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)?△H?= —28.5 kJ·mol-1
(2)①?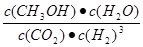 ?;②< ; ③>
?;②< ; ③>
(3)(2)2NH3+CO2 CO(NH2)2+H2O? 40 %?②CO2+8e—+8H+=CH4+2H2O
CO(NH2)2+H2O? 40 %?②CO2+8e—+8H+=CH4+2H2O
本题解析:(1) ①-②×3,整理可得Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)?△H?= —28.5 kJ/mol。(2)①化学平衡常数是可逆反应达到平衡状态时各种生成物浓度的幂指数的乘积与各种反应物浓度的幂指数的乘积的比。对该反应来说,K=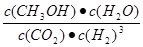 。②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动。根据偏高移动原理:升高温度梦幻西游平衡向吸热反应方向移动。逆反应方向为吸热反应,所以正反应为放热反应。所以ΔH<0。 ③曲线Ⅱ比I先达到平衡。说明温度温度曲线Ⅱ>I。由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ。(3)①根据质量守恒定律,由CO2和NH3在一定条件下合成尿素[CO(NH2)2]的反应方程式为2NH3+CO2
。②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动。根据偏高移动原理:升高温度梦幻西游平衡向吸热反应方向移动。逆反应方向为吸热反应,所以正反应为放热反应。所以ΔH<0。 ③曲线Ⅱ比I先达到平衡。说明温度温度曲线Ⅱ>I。由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ。(3)①根据质量守恒定律,由CO2和NH3在一定条件下合成尿素[CO(NH2)2]的反应方程式为2NH3+CO2 CO(NH2)2+H2O。
CO(NH2)2+H2O。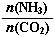 =3,假设n(CO2)=amol,则n(NH3)=3amol。由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6amol.,根据方程式中二者的物质的量的关系可知反应的NH3的物质的量n(NH3)=1.2amol.所以氨气的转化率为(1.2amol.÷3amol)×100%=40%.②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,则根据题意可得:该电极反应的方程式为CO2+8e—+8H+=CH4+2H2O。
=3,假设n(CO2)=amol,则n(NH3)=3amol。由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6amol.,根据方程式中二者的物质的量的关系可知反应的NH3的物质的量n(NH3)=1.2amol.所以氨气的转化率为(1.2amol.÷3amol)×100%=40%.②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,则根据题意可得:该电极反应的方程式为CO2+8e—+8H+=CH4+2H2O。
本题难度:一般