时间:2017-09-23 22:54:49
1、选择题 关于可逆反应mA(g)+nB(g)  pC(g)+qD(g)及其图象的说法正确的是(?)
pC(g)+qD(g)及其图象的说法正确的是(?)
A.若图象为Ⅰ,则m+n>p+q
B.若图象为Ⅱ,则m+n=p+q,t2时刻改变的条件一定是使用催化剂
C.若图象为Ⅲ,则该可逆反应的ΔH<0
D.若图象为Ⅳ,且压强p1>压强p2,则该可逆反应的ΔH>0
参考答案:D
本题解析:若图象为Ⅰ,说明压强越大,A的转化率越低,则m+n<p+q,A错误;若图象为Ⅱ,且m+n=p+q,t2时刻改变的条件可能是增大压强,B错误;若图象为Ⅲ,根据温度越高,反应速率越快,达到平衡时间越短,则T1>T2,温度高时C的含量高,则ΔH>0,C错误;若图象为Ⅳ,且p1>p2,说明温度越高、压强越大,C的含量越高,则ΔH>0,m+n>p+q。
本题难度:一般
2、选择题 在密闭容器中进行反应:X2(g)+3Y2(g) 2Z(g)其中X2、Y2、Z的起始溶度分别为0.10 mol/L、0.30 mol/L、0.20 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是(?)
2Z(g)其中X2、Y2、Z的起始溶度分别为0.10 mol/L、0.30 mol/L、0.20 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是(?)
A.c(Z)="0.50" mol/L
B.c(Y2)="0.50" mol/L
C.c(X2)="0.20" mol/L
D.c(Y2)="0.60" mol/L
参考答案:B
本题解析:若反应向正反应方向进行,0.1mol/LX2与0.3mol/LY2全部反应可生成0.2mol/LZ,这表明平衡时Z的浓度应小于0.4mol/L;若反应向逆反应方向进行,0.2mol/LZ全部分解时可生成0.1mol/LX2和0.3mol/LY2,这表明平衡时X2的浓度应小于0.2mol/L,Y2的浓度应小于0.6mol/L。
本题难度:简单
3、选择题 工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率
B.已知,一定温度下,反应的平衡常数(k)为定值,若向已经达到平衡状态的容器中再次加入四种物质,若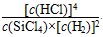 >k,平衡就要向正反应方向移动
>k,平衡就要向正反应方向移动
C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收
参考答案:D
本题解析:正反应是体积减小的可逆反应,所以增大压强平衡平衡向逆反应方向移动,反应物的转化率降低,A不正确;B不正确,应该是向逆反应方向移动;C不正确,氢气的浓度变化量是0.12mol/L÷2=0.06mol/L,所以氢气的反应速率是0.06mol/L÷4min=0.015 mol/(L·min);反应吸收热量为0.025Q kJ时,生成的HCl是0.1mol,恰好和0.1mol氢氧化钠反应,D正确,答案选D。
点评:在判断外界条件对反应速率的影响时,应该利用勒夏特列原理进行分析和判断。
本题难度:一般
4、填空题 现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。 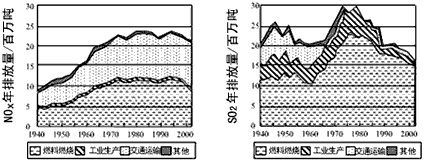
(1)结合上图数据,判断下列说法正确的是______。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量下降,主要是减少了燃烧的煤的量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:____________________。
(3)汽车排放的尾气中含有未燃烧充分的碳氢化合物以及N2、CO2、NO、CO等。有人设计利用反应
2NO+2CO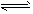 N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
在上述条件下反应能够自发进行,则反应的△H_____0(“>”、“<”或“=”)。前2h内的平均反应速率v(N2)=______。据此你认为将该反应从理论转化为现实的最重要的研究方向是______________。
(4)某次降雨过程收集到10 L的雨水,向雨水中滴加1 mL 6 mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4 mol/L,再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为
0. 1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请写出将H2O2加入到雨水中与含硫化合物反应的离子方程式______________,并计算排放到空气中的NOx和SO2的物质的量之比接近于_______。
参考答案:(1)BD
(2)CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
(3)<;1.875×10-4 mol·L-1·h-1;寻找高效的催化剂
(4)H2O2+SO2=2H++SO42-;1:1
本题解析:
本题难度:一般
5、选择题 一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)  2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是
A.单位时间里生成n mol S2Cl2的同时也生成n mol SCl2
B.达到平衡时,若升高温度,压强不变,氯气转化率增大
C.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2
D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
参考答案:C
本题解析:所给可逆反应为两边气体系数相等的放热反应,升温,平衡左移,氯气的转化率减小,但气体的总物质的量不变,B错;加入氯气,平衡正移,但其本身的转化率降低,D错;
A:由于不知可逆反应是否为平衡状态,所以单位时间里生成的各物质的量没有定量关系。
C:该选项能表示出正逆反应速率相等,表述正确。
本题难度:简单