时间:2017-09-23 22:47:23
1、选择题 对于碳酸溶液中的电离平衡,电离常数的表达式中正确的是
[? ]
A.K=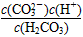
B.K=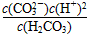
C.K1=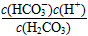
D.K2=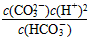
参考答案:C
本题解析:
本题难度:简单
2、选择题 在同一温度下,当弱电解质溶液a,强电解质溶液b,金属导体c的导电能力相同,若升高温度后,它们的导电能力是(?)
A.a>b>c
B.a="b=c"
C.c>a>b
D.b>c>a
参考答案:A
本题解析:对弱电解质溶液a来说,升高温度能促进其电离,自由移动的离子浓度增大,导电性增强。对强电解质溶液b来说,升高温度,自由移动的离子浓度基本不变,导电性不变。对金属c来说,升高温度,电阻增大,导电性减弱。
本题难度:简单
3、选择题 下表是在相同温度下,三种酸的一些数据,下列说法正确的是
A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1
B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)×c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.相同温度下,K5>K4>K3
参考答案:D
本题解析:A、电离常数只受温度的影响,温度不变,电离平衡常数不变,即K1=K2=K3,错误;B、根据题意HZ是弱酸,NaZ是强碱弱酸盐,Ka=c(H+)×c(Z-)/c(HZ),Kw=c(H+)×c(OH-),c(Z-)/[c(HZ)×c(OH-)]=Ka×Kw,两个只受温度的影响,说法错误;C、根据数据,得出酸性强弱的顺序:HZ>HY>HX,酸性越强,水解程度越小,c(Z-)>c(Y-)>c(X-),错误;D、酸性越强,电离程度越强,电离常数越大,所以K5>K4>K3,正确。
考点:考查电离常数、盐类水解的规律等相关知识。
本题难度:困难
4、选择题 常温下,浓度均为0.1mol·L-1 CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。
下列叙述中不正确的是
A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小
B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大
C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)
参考答案:
本题解析:
本题难度:一般
5、选择题 常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
参考答案:D
本题解析:氢氧化钠是一元强碱,醋酸是一元弱酸,在浓度相同的条件下,氢氧化钠抑制水的电离程度大,即由水电离出的c(H+):①<③,A不正确;醋酸是弱酸,所以③稀释到原来的100倍后,pH>3,B不正确;①与③混合,如果二者恰好反应,则溶液显碱性。若溶液pH=7,则说明醋酸是过量的,因此V(NaOH) <V(CH3COOH),C不正确;D中醋酸过量时,可以出现该情况,因此正确的答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,灵活性强,注重考查学生分析问题、解决问题的能力,有助于培养学生严谨的逻辑思维能力和发散思维能力。
本题难度:简单