时间:2017-09-23 22:47:23
1、填空题 (11分)
(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1) 烧杯中放入锌的质量大(填“甲”或“乙”);
(2) 烧杯中的酸过量(填“甲”或“乙”);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+) (填“大”或“小”)。
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸 ④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B ⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是 。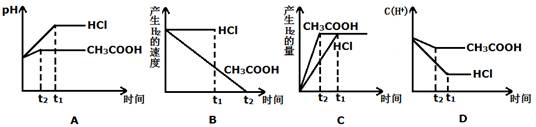
参考答案:(11分)
(Ⅰ)(1)甲 (2)乙 (3)大 (每空2分)
(Ⅱ)③⑤ (2分)
(Ⅲ)ACD (3分)
本题解析:
试题解析:(I)(1)盐酸为强酸,醋酸为弱酸。体积和pH相等,可得n(HCl)<n(CH3COOH)。由于金属跟盐酸、醋酸的反应都是按1:2的比例进行反应的。因此与盐酸反应的锌应过量。
(2)得到相同质量的氢气,则反应掉的酸的物质的量相等,因此乙中的醋酸应剩余。
(3)反应后甲烧杯中的溶质为ZnCl2,乙烧杯中的溶质为(CH3COO)2Zn和CH3COOH;乙烧杯中的溶液为酸性,因此应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大。
(Ⅱ)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应。⑴若锌完全反应,则产生的H2相等;若醋酸完全反应,则产生的H2不相等。因此①②错误。⑵由于加入的锌的质量相等 ,而溶液中n(HCl)<n(CH3COOH),因此若有一份溶液中的锌有剩余,则应是盐酸中的锌有剩余,故③正确。⑶等倍稀释后,由于稀释促进了醋酸的水解,醋酸中c(H+)增大,因此反应速率增大,故④错误。⑷由于随着反应的进行,盐酸中c(H+)不断减小,而对于醋酸溶液中,c(H+)几乎保持不变,因此产生等量的H2所需的时间A>B,故⑤正确。⑸若产生等量的H2,可以是两种酸都有剩余,也可以是醋酸有剩余,故⑥错误。综上,说法正确的有③⑤。
(Ⅲ) 向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,反应后溶液的溶质分别为“ZnCl2和ZnCl2、CH3COOH”,因此A正确。对于选项B、对于产生H2的速率,应是与盐酸反应的会越来越慢;与醋酸反应的,其反应速率基本保持不变,故B错误。选项C、锌的质量相等,其完全反应,因此产生H2的质量想的,再结合对选项B的分析,可知,C图像表示的正确。选项D、随着反应的进行,盐酸中c(H+)不断减小,但醋酸会不断电离出H+,因此其浓度减小的较慢,因此选项D说法正确。综上,答案选ACD。
考点:电解质溶液;弱酸的电离
点评:本题考查电解质溶液的相关知识,是高考的常见考题,掌握弱酸的电离是解题的关键。对于此类题型,应加强训练总结,以求达到举一反三的效果。
本题难度:一般
2、选择题 某二元弱酸(简写为H2A)在水溶液中按下式发生一级和二级电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。下列对0.1 mol·L-1 H2A溶液的有关叙述错误的是(? )
H++A2-。下列对0.1 mol·L-1 H2A溶液的有关叙述错误的是(? )
A.从阴离子HA-中电离出H+比从H2A分子电离出H+更困难
B.H2A电离出的H+会抑制HA-的电离
C.溶液中c(H+)与c(HA-)接近于相等,且c(H+)略大于c(HA-)
D.溶液中c(H+)等于c(A2-)
参考答案:D
本题解析:可将此题中二元弱酸视为H2S来分析,一级电离大于二级电离,且一级电离产生的H+对二级电离有抑制作用。
本题难度:简单
3、选择题 有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
[? ]
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中,以Z-最易发生水解
D.中和1molHY酸,需要的NaOH稍小于1mol
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列液体均处于25℃,有关叙述正确的是?(?)
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.在1 mol/L的氨水中,改变外界条件使c(NH4+)增大,则溶液的pH一定增大
D.NaHCO3溶液中:c(Na+)=2c(CO )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)
参考答案:B
本题解析:略
本题难度:一般
5、选择题 pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是
A.X是强酸,Y是弱酸
B.X是弱酸,Y是强酸
C.X是二元酸,Y是一元酸
D.无法判断X、Y的上述性质
参考答案:D
本题解析:若两种酸均是强酸,则溶液中氢离子浓度相同,但是两种酸的体积未知,X酸的体积大于Y的体积,则酸X比酸Y产生的氢气多;若X是弱酸,Y是强酸,二者的体积相同,酸X比酸Y产生的氢气多,都符合题意,所以X、Y的性质无法判断,答案选D。
考点:考查对题意的分析,酸与金属反应的判断
本题难度:一般