时间:2017-09-23 22:41:35
1、选择题 100℃时水的离子积Kw=1×10-12。这时将等体积硫酸和氢氧化钠溶液混合,若溶液混合后显中性,则混合前硫酸的pH和氢氧化钠溶液的pH之和为
A.12
B.14
C.13
D.15
参考答案:A
本题解析:此溶液为中性则不影响水的电离所以该溶液中的C(H+)=C(OH-)=10-6
不难得出其PH值之和为12
本题难度:一般
2、选择题 已知水的电离平衡曲线如图所示,试回答下列问题: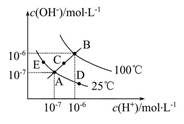
(1)图中五点Kw间的关系是?。
(2)若从A点到D点,可采用的措施是?。
a.升温?b.加入少量的盐酸? c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为?。
参考答案:(1)B>C>A=D=E? (2)b、c? (3)10∶1
本题解析:(1)Kw只与温度有关,温度升高促进水的电离,Kw增大,因此有B>C>A=D=E。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25 ℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5 mol/L=V(H2SO4)×10-4 mol/L,得V(NaOH)∶V(H2SO4)=10∶1。
本题难度:一般
3、选择题 用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( )
A.4
B.7.2
C.10
D.11.3
参考答案:C
本题解析:运用化学反应进行中和反应计算
c(OH-)=1×10-4 mol·L-1,pH=10。
本题难度:一般
4、选择题 已知C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是(?)
A.2CO(g) + O2(g) = 2CO2(g); △H= +282.8kJ/mol
B.2H2(g) + O2(g) = 2H2?O(g); △H= -571.6kJ/mol
C.C(石墨,s) + 1/2O2(g) =" CO(g);" △H= -110.7kJ/mol
D.燃烧前混合气体中,H2的体积分数为40%
参考答案:D
本题解析:略
本题难度:简单
5、选择题 在同温同压下,下列各组热化学方程式中 Q1 <Q2的是(反应条件已略去)
A.2H2(g) + O2(g) = 2H2O(g) ;△H=-Q1 , 2H2(g) + O2(g) = 2H2O(l) ;△H=-Q2
B.S(g) + O2(g) = SO2(g) ;△H=-Q1 , S(s) + O2(g) = SO2(g) ;△H=-Q2
C.C(s) + 1/2O2(g) =" CO(g)" ;△H=-Q1 , C(s) + O2(g) = CO2(g) ;△H=-Q2
D.H2(g) + Cl2(g) =" 2HCl(g)" ;△H=-Q1 , 1/2H2(g) + 1/2Cl2(g) =" HCl(g)" ;△H=-Q2
参考答案:AC
本题解析:氢气燃烧生成液态水时放热多,A正确。气态S的能量高于固态S的能量,所以气态S燃烧放热多,B不正确。碳完全燃烧放热多,C正确。参加反应的氢气越大,放热越多,D不正确,答案选AC。
本题难度:一般