时间:2017-09-23 22:41:35
1、选择题 将标准状况下体积为2.24L的H2S缓慢通入100ml, 1.5mol/LNaOH溶液中(溶液体积变化忽略不计),充分反应,下列关系错误的是?(?)
A.c(Na+)+ c(H+)= c(HS-)+2 c(S2-)+ c(OH-)
B.c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-)
C.c(Na+)>[c(HS-)+c(S2-)+c(H2S)]
D.c(HS-)+c(S2-)+c(H2S)=1.0mol/L
参考答案:B
本题解析:H2S的物质的量是0.1mol,氢氧化钠的物质的量是0.15mol,这说明反应后生成的是等物质的量浓度的Na2S和NaHS,溶液显碱性,B不正确;A符合电荷守恒,正确;C和D符合符合物料守恒,正确,答案选B。2S和氢氧化钠溶液反应后溶液中离子浓度大小比较
点评:该题是高考中的常见考点和题型,属于中等难度的试题。试题贴近高考,综合性强,注重考查学生分析问题、解决问题的能力。该题的关键是准确判断出溶液中的溶质,然后结合各种守恒即可得出正确的结论。
本题难度:简单
2、选择题 对于常温下0.0lmol/L的氨水,下列叙述正确的是
A.c(H+)+c(NH4+)=c(OH-)
B.与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3· H2O)="0.02" mol·L-1
C.与等体积等浓度的盐酸混合后所得溶液显酸性
D.由H2O电离出的c(H+)=1.0×10-12 mol·L-1
参考答案:AC
本题解析:氨水中只有一水合氨和水是电解质,分别能部分电离出铵根离子、氢离子和氢氧根离子三种离子,根据溶液呈电中性或电荷守恒原理,则溶液中c(OH-)=c(NH4+)+c(H+),正确;设溶液的体积均为1L,由于n=c?V,则混合前一水合氨和氯化铵的物质的量都是0.01mol,n(NH4+)+n(NH3·H2O)=0.01mol+0.01mol=0.02mol,两种稀溶液的密度都接近于水,则混合前后可以忽略溶液体积的变化,则混合后溶液的体积为2L,根据物料守恒原理可知,混合溶液中n(NH4+)+n(NH3·H2O)=0.02mol,由于c=n/V,因此混合后溶液中c(NH4+)+c(NH3·H2O)=0.02mol/2L=0.01mol/L,故B错误;设溶液的体积均为1L,由于n=c?V,混合前一水合氨和HCl的物质的量相等,则混合时二者恰好完全中和,得到氯化铵和水,NH4Cl是强酸弱碱盐,其完全电离出铵根离子能部分水解,导致氯化铵溶液显酸性,故C正确;依题意,常温下c(NH3·H2O)=0.01mol/L,NH3·H2O是弱碱或弱电解质,则其电离出的c(OH-)<0.01mol/L,由于水的电离程度远小于一水合氨,则溶液中的c(OH-)<0.01mol/L,常温下Kw=1.0×10-14,则溶液中c(H+)=Kw/c(OH-)>1.0×10-12 mol·L-1,由于溶液中的氢离子来自水的电离,一水合氨不能电离出氢离子,则水电离出的c(H+)=溶液中c(H+)=>1.0×10-12 mol·L-1,故D错误。
本题难度:简单
3、选择题 在200 mL某硫酸盐溶液中含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为(? )
A.1 mol·L-1
B.2.5 mol·L-1
C.5 mol·L-1
D.2 mol·L-1
参考答案:B
本题解析:
正确答案:B
有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的化学式为M2 (SO4)3 , 该硫酸盐的物质的量浓度为1.5mol÷3÷0.200L="2.5" mol·L-1,故B正确。
本题难度:一般
4、选择题 往装有25mL盐酸的锥形瓶中逐滴加入NaOH溶液[用V(NaOH)代表加入的NaOH溶液的体积],下列曲线能正确表示此变化过程的是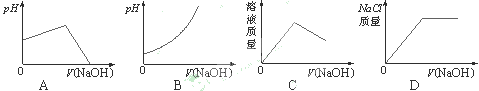
参考答案:D
本题解析:氢氧化钠滴定盐酸,则溶液的pH逐渐增大,但不可能无限的增大,所以AB不正确。溶液的质量是逐渐增大的,C不正确,所以正确的答案选D。
本题难度:一般
5、选择题 将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是(?)
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
参考答案:B
本题解析:A项:由图像可知当 HCl溶液10ml时,中和后溶液的温度为22℃,所以环境温度应该小于22℃。C项:当HCl溶液30ml时,两溶液恰好中和,可推出NaOH溶液的浓度约是1.5 mol/L;
本题难度:一般