时间:2017-09-23 22:25:53
1、选择题 在其它条件一定时,图中曲线表示反应2NO(g) + O2(g)  2NO2(g)(吸热反应)达平衡时
2NO2(g)(吸热反应)达平衡时
NO的转化率与温度的关系,图上标有A、B、C、D、E点,
其中表示未达平衡状态且V正>V逆的点是?
A、A或E?
B、B点?
C、C点?
D、D点
参考答案:C
本题解析:略
本题难度:简单
2、选择题 将一定量的固体Ag2SO4置于容积不变的密闭容器中(装有少量V2O5),某温度下发生反应:
Ag2SO4(s)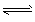 Ag2O(s)+SO3(g),
Ag2O(s)+SO3(g),
2SO3 (g) 2SO2(g)+O2(g)。
2SO2(g)+O2(g)。
反应经 10min达到平衡,测得c(SO3) =0. 4mol/L,c(SO2) =0.1mol/L。则下列叙述中不正确的是
[? ]
A.容器里气体密度为40g·L-1
B.化学反应速率为v(Ag2SO4) =v(SO3)
C.SO3的分解率为20%
D.在这10min内的平均反应速率v(O2) =0. 005mol/(L·min)
参考答案:B
本题解析:
本题难度:一般
3、选择题 一定温度下,对可逆反应A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达平衡的是
3C(g)的下列叙述中,能说明反应已达平衡的是
A:C生成的速率和C分解的速率相等
B:单位时间内消耗amolA同时生成3amolC
C:容器内的压强不再变化
D:混合气体的物质的量不再变化
参考答案:A
本题解析:略
本题难度:一般
4、填空题 在密闭容器中,充入一定量的N2和H2,在一定条件下合成氨,若以v(H2)、v(N2)分别表示消耗速率,v(NH3)表示分解速率,那么,该反应达到平衡前,用“>”“<”或“=”表示下列关系:
(1)v(H2)____________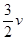 (NH3)。
(NH3)。
(2)v(H2)____________3(N2)。
参考答案:(1)>(2)=
本题解析:(1)反应达到平衡前,正反应速率大于逆反应速率,v(H2)>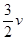 (NH3)。
(NH3)。
(2)v(H2)、v(N2)均表示正反应速率,无论是否达到平衡,v(H2)∶v(N2)=3∶1。
本题难度:简单
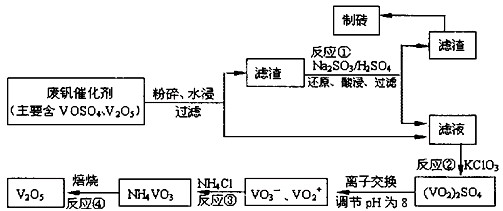
5、计算题 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____; 增大的是_____。
增大的是_____。参考答案:(14分)(1)3V2O5+10Al 6V+5Al2O3(2分);(2)将V2O5转化为可溶的VOSO4(2分)
6V+5Al2O3(2分);(2)将V2O5转化为可溶的VOSO4(2分)
⑶VO2++2OH-=VO3-+H2O(3分) ⑷坩埚(2分); ⑸1620(3分);C(2分)
本题解析:(1)铝是活泼的金属,能和金属氧化物发生铝热反应,所以铝和五氧化二钒发生铝热反应的化学方程式为3V2O5+10Al 6V+5Al2O3。
6V+5Al2O3。
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成可溶性的VOSO4,所以反应①的目的是将V2O5转化为可溶的VOSO4。
(3)VOSO4有强氧化性,能把氯酸钾氧化,自身被还原成(VO2)2SO4。在碱性条件下,VO2+转化为VO3-,反应的离子方程式是VO2++2OH-=VO3-+H2O。
(4)固体加热需要在坩埚中进行,因此必不可少的是坩埚。
(5)①? 2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol/L)? 1.0? 0.5? 0
转化浓度(mol/L)? 2x? x? 2x
平衡浓度(mol/L)? 1.0-2x? 0.5-x? 2x
一定条件下达到平衡,SO3的体积分数为
则有
解得x=0.45
所以该温度下可逆反应的平衡常数K= =
=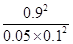 =1620
=1620
②A.正方应是放热反应,则升高温度平衡向逆反应方向移动,因此 减小;
减小;
B.保持温度和容积不变,再充入2 mol He,反应物和生成物的浓度不变,平衡不移动,因此 不变;
不变;
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2,相当于是增大压强,平衡向正方应移动,因此 增大;
增大;
D.催化剂只能改变反应速率,但不能改变平衡状态,因此不用V2O5作催化剂,改用其它更高效催化剂使, 不变,答案选C。
不变,答案选C。
本题难度:一般