时间:2017-09-23 22:25:53
1、选择题 在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)?C(g)+D(g),5 min后达到平衡,已知各物质的平衡浓度的关系为ca(A)·c(B)= c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率没有发生变化,则B的转化率为( )
A.60%? B.40%? C.24%?D.4%
参考答案:B
本题解析:在温度不变的情况下将容器的体积扩大10倍,A的转化率没有发生改变,说明该反应为反应前后气体体积不变的反应,所以a=1。B的转化率也没有发生变化,所以与没有扩大容器体积前一样。设容器的体积为V,转化的A的物质的量为x,则达到平衡时A、B、C、D的物质的量分别为2 mol-x、3 mol-x、x、x。根据ca(A)·c(B)=c(C)·c(D)可知(x/V)2=(2/V-x/V)(3/V-x/V),解得x=1.2 mol,所以B的转化率为1.2 mol/3 mol×100%=40%,B对。
本题难度:一般
2、填空题 (2014届浙江省嘉兴市高三教学测试(二)理综化学试卷)
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(g)?△H1<0
4NO(g)+CO2(g)+2H2O(g)?△H1<0
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)?△H2<0
2N2(g)+CO2(g)+2H2O(g)?△H2<0
③CH4(g) +2NO2(g) N2(g) +CO2(g) +2H2O(g)?△H3=?。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g)?△H3=?。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |


参考答案:(1) ?(1分)
?(1分)
(2)① ?(1分)?不变?(2分)
?(1分)?不变?(2分)
② 17.4%?(2分)
(3)① NO+ O2 --2e- = NO2?(2分)
② 1 : 1?(2分)
(4)① 原因是:在250℃-450℃时,反应未达到平衡,反应还在正向进行。?(1分)
450℃-600℃时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高而减小。(其他合理答案也给分)?(1分)
② BCF?(2分)
本题解析:
(1) 即为目标方程式③,所以,
即为目标方程式③,所以,
(2)① 该反应的平衡常数的表达式 
② 平衡常数K不受浓度和压强的影响,只受温度的影响,温度不变K不变。
③ 400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数为:
CH4(g)?+? 2NO2(g)  ?N2(g) + CO2(g) + 2H2O(g)
?N2(g) + CO2(g) + 2H2O(g)
n始? 0.02? 0.02? 0? 0? 0
n转? 0.006? 0.02×0.6=0.012? 0.006? 0.006? 0.012
n平? 0.014? 0.008? 0.006? 0.006? 0.012
0.014 + 0.008 + 0.006 + 0.006 + 0.012 = 0.046
平衡时NO2的体积分数=
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪实际上就是应用原电池原理,从图1可知Pt电极(通入O2的一极)为电池的正极,NiO电极(通入NO的一极)为电池的负极,O2 –可以通过固体电解质移向负极。所以,
① NiO电极上NO发生的电极反应式:NO+ O2 --2e- = NO2。
②1×104L(标准状况下)尾气中含NOx的体积为:1×104L×1.12% = 112L,
NOx的物质的量为: 。
。
设NO和NO2的物质的量分别为x、y mol,根据反应化学方程式①和②:
① CH4(g) + 4NO2(g) 4NO(g) + CO2(g)+2H2O(g)?
4NO(g) + CO2(g)+2H2O(g)?
16g? 4? 4
m 1?y? y? m 1 = 4y
② CH4(g) + 4NO(g) 2N2(g) + CO2(g)+2H2O(g)?
2N2(g) + CO2(g)+2H2O(g)?
16g? 4?
m 2 ?(x+y)? m 2 = 4(x+y)
则: x+y = 5;4(x+y)+ 4y = 30
解得:x ="2.5" mol ?=" 2.5" mol
所以,尾气中V(NO)︰V(NO2) =" 1" ︰ 1 。
(4)①从图2 变化曲线分析,结论二的原因是:在250℃-450℃时,反应未达到平衡,反应还在正向进行;故NOx转化率随温度升高而增大;在在450℃-600℃时反应已达到平衡状态,因为该反应是放热反应,此时温度升高平衡逆向移动,故 NOx转化率随温度升高而减小。
② 由上述NO2和CH4反应的化学方程式的特点分析可知: 该反应是放热反应;该反应是扩大气体体积的反应。所以要提高NO2转化率,可降低温度,降低温度能使平衡正向移动,从而提高NO2转化率;分离出H2O,相当于减小生成物的浓度,使平衡正向移动,从而提高NO2转化率;减小投料比[n(NO2) / n(CH4)],相当于增加反应物CH4的浓度,使平衡正向移动,从而增大NO2转化率。而使用催化剂只能改变反应速率,不影响平衡移动,故NO2转化率不会变化。增大压强,平衡逆移,NO2转化率会减小。因此选B C F。
本题难度:一般
3、选择题 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是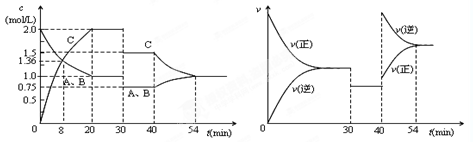
A.前8min A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等
参考答案:B
本题解析:某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,30min时发现C和A.B的浓度都下降了;反应速率也是都减小,但是平衡不移动,说明反应方程式中的x=1;所以30min时扩大容器的体积。40min时C的浓度下降,AB的浓度上升;正逆反应速率都增大,逆反应的速率增大的快;说明40min时升高温度,正反应为放热热反应;30min和54min的反应的温度不同,所以平衡常数不同。前8min A的平均反应速率必须指明物质是谁。故选B。
2C(g),达到平衡后,只改变反应的一个条件,30min时发现C和A.B的浓度都下降了;反应速率也是都减小,但是平衡不移动,说明反应方程式中的x=1;所以30min时扩大容器的体积。40min时C的浓度下降,AB的浓度上升;正逆反应速率都增大,逆反应的速率增大的快;说明40min时升高温度,正反应为放热热反应;30min和54min的反应的温度不同,所以平衡常数不同。前8min A的平均反应速率必须指明物质是谁。故选B。
点评:.对于化学反应速率的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物;一般生成物多数以原点为起点。
(3)抓住变化趋势,分清正、逆反应,吸、放热反应。升高温度时,v(吸)>v(放),在速率一时间图上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。例如,升高温度时,v(吸)大增,v(放)小增;增大反应物浓度时,v(正)突变,v(逆)渐变。
(4)注意终点。例如在浓度一时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
本题难度:一般
4、选择题 下列事实不能用勒夏特列原理解释的是(?)
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)  K(g)+NaCl(l)
K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
A.①②③
B.②⑥
C.①③④⑤
D.②⑤⑥
参考答案:B
本题解析:②不是化学平衡;⑥平衡的移动应使颜色变浅,颜色变深是体积缩小、浓度变大造成的。
本题难度:一般
5、选择题 二氧化氮存在下列平衡:2NO2 ?N2O4?ΔH<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是
?N2O4?ΔH<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是
A.温度130 ℃、压强 3.03×105 Pa
B.温度130 ℃、压强5.05×104 Pa
C.温度25 ℃、压强1.01×105 Pa
D.温度0 ℃、压强5.05×104 Pa
参考答案:B
本题解析:测定NO2相对分子质量,应使平衡向逆反应方向移动,所以应选择高温、低压。
点评:根据题设考虑化学反应条件的控制。
本题难度:一般