时间:2017-09-23 22:25:53
1、选择题 在容积为1L的固定密闭容器中充入2mol氨气,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),达到平衡时容器内c(N2)为0.5mo
2NH3(g),达到平衡时容器内c(N2)为0.5mo l/L,若温度和体积不变,按下列物质的量加入起始物质,达平衡时容器内c(N2)不能维持0.5mol/L的是
l/L,若温度和体积不变,按下列物质的量加入起始物质,达平衡时容器内c(N2)不能维持0.5mol/L的是
A.1molN2和3molH2
B.2molNH3和1molHe
C.2molNH3 、1molN2和3molH2
D.0.1molNH3 、0.95molN2和2.85molH2
参考答案:C
本题解析:略
本题难度:一般
2、选择题 通常情况下氧气的密度是1.28 g/L,在实验室中利用KClO3制氧气,生成氧气的平均速率为0. 01
mol/(L·min),现要制取500 mL氧气,需要的时间为
[? ]
A.1 min
B.2 min
C.3 min
D.4 min
参考答案:D
本题解析:
本题难度:简单
3、选择题 在一定条件下X2(g)+3Y2(g) ?2Z3(g)?达到化学平衡状态后,采取下列措施平衡不会发生移动的是
?2Z3(g)?达到化学平衡状态后,采取下列措施平衡不会发生移动的是
A.充入X2
B.缩小容器的体积
C.升高温度
D.使用催化剂
参考答案:D
本题解析:该反应是体积减小的可逆反应,所以压强能影响平衡。任何反应都会伴随能量的变化,所以温度一定会影响平衡,X2是气体,改变其浓度可以改变平衡状态。催化剂能同等程度改变正逆反应速率,因此使用催化剂不能改变平衡状态。答案是D。
本题难度:一般
4、填空题 (12分)在一定条件下,存在如下反应:2SO2(g)+ O2 (g)  ?2SO3(g);ΔH<0
?2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K= ?
(2)升高温度,该反应K值?,SO2转化率?,正反?
应速率?(填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是?
(4)据图判断,反应进行至20min时,曲线发生变化的原因?
是___________________(用文字表达),10min到15min的曲线变化的原因可能是?(填编号)。?
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量
(5)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__?____ 。
参考答案:(12分)
(1)(1分)
6.减小、减小、增大?(各1分,共3分)(3)15-20min和25-30min (2分)
(4)增大O2浓度(通入O2)(1分)? AB(2分)
(5)中(1分)? Kb=10-9/(a-0.01)mol·L-1.(单位不算分,2分)
本题解析:略
本题难度:一般
5、选择题 在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是?(? )
A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
B.平衡时,N2O4的转化率为60%
C.平衡时,体系内NO2为0.04mol·L-1
D.在2s时,体系内压强为反应前的1.1倍
参考答案:C
本题解析:反应进行到2s时,NO2的浓度为0.02mol·L-1,所以前2s,NO2的平均反应速率为0.01mol·L-1·s-1。根据反应速率之比是相应的化学计量数之比可知,前2s,N2O4的平均反应速率为0.005mol·L-1·s-1,A正确。在2s时,容器内NO2的物质的量是0.1mol,消耗N2O40.05mol,在2s时,体系内压强为反应前的 倍,D正确。
倍,D正确。
N2O4(g) 2NO2(g)
2NO2(g)
起始量(mol)? 0.5? 0
转化量(mol)? x? 2x
平衡量(mol)? 0.5-x? 2x
因此有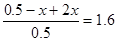 ,解得x=0.3。所以平衡时,N2O4的转化率为
,解得x=0.3。所以平衡时,N2O4的转化率为 。平衡时体系内NO2为0.6mol,其浓度是0.12 mol·L-1。所以答案是C。
。平衡时体系内NO2为0.6mol,其浓度是0.12 mol·L-1。所以答案是C。
本题难度:一般