时间:2017-08-26 03:11:28
1、选择题 2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g) PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
[? ]
A.0.40mol
B.0.20mol
C.小于0.20mol
D.大于0.20mol,小于0.40mol
参考答案:C
本题解析:
本题难度:一般
2、填空题 (5分)(1)在一密闭容器中充入1molNO2,建立如下平衡:2NO2 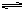 ?N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___?_。
?N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___?_。
(2)汽车尾气中的主要污染物有CO、NOx,CO分析仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是?。
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,试回答下列问题:
①若电解质溶液为KOH溶液,构成燃料电池,则负极反应式为____________?____,
②如把KOH改为稀H2SO4作电解质,则正极反应式为_____?___________,
③如把H2改为甲烷,KOH作电解质,则负极反应式为?
参考答案:(1)b>a?(2)B? (3)? ①2H2+4OH--4e-===4H2O? ②?O2+4H++4e-===2H2O ③ CH4-8e-+10 OH-=CO32-+7 H2O
本题解析:(1)由于反应物和生成物都是一种,所以再通入NO2相当于增大压强,平衡向正反应方向移动,转化率增大。原电池中阳离子向正极移动,阴离子向负极移动。根据装置图可判断,a是负极,CO被氧化。b是正极,氧气被还原。所以选项B是错误的。(3)负极失去电子,所以氢气通入负极,氧气通入正极。若用甲醇作燃料,则甲醇在负极失去电子,由于溶液是氢氧化钾溶液,所以生成物是碳酸钾和水。
本题难度:一般
3、选择题 反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是
2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是
[? ]
A.?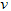 (D)=0.4?mol?/(L·s)
(D)=0.4?mol?/(L·s)
B.?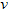 (C)=0.5?mol?/(L·s)
(C)=0.5?mol?/(L·s)
C.?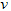 (B)=0.6?mol?/(L·s)
(B)=0.6?mol?/(L·s)
D.?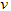 (A)=0.15?mol?/(L·s)
(A)=0.15?mol?/(L·s)
参考答案:B
本题解析:
本题难度:简单
4、选择题 对于可逆反应:2A(g)+B(g)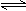 2C(g)?△H<0,下列各图正确的是(?)
2C(g)?△H<0,下列各图正确的是(?)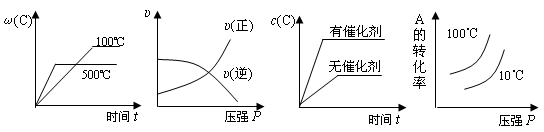
A? B? C? D
参考答案:A
本题解析:B、增大压强,正逆反应速率同时增大,平衡向正向移动;
C、催化剂不能使平衡移动,平衡时c(C)相同;
D、温度升高,平衡逆向移动,A的转化率减小,故100℃在下。
本题难度:一般
5、填空题 (16分)在一个固定体积的密闭容器中发生某反应,当改变其他反应条件,在I、II、III阶段,体系中各物质浓度随时间变化的曲线如下图所示: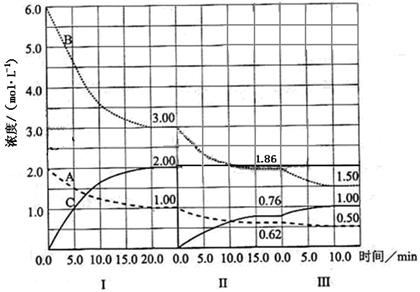
(1)该反应的化学方程式为?(物质用图中的“A”、“B”、“C”表示),该反应在第I阶段的平衡常数为?。
(2)第III阶段,从开始至平衡,用B表示的平均反应速率为?;
(3)第I阶段,A的转化率为?;第III阶段达平衡后,C的体积分数为?;
(4)由第一次平衡到第二次平衡,平衡移动的方向是?,采取的措施是?;
(5)已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),则该反应的正反应
△H?0(填“<”或“>”)
参考答案:⑴方程式为? A+3B  2C?,平衡常数为? 4/27?。
2C?,平衡常数为? 4/27?。
⑵? 0.036mol/(L·min)?;
⑶? 50%?; 33%? ;
⑷?正移?,措施是将C从平衡混合物中分离出去?;⑸△H? >? 0
本题解析:A+3B  2C第III阶段,从开始至平衡,用B表示的平均反应速率为0.36mol/L.10min=0.036mol/(L·min). 由第一次平衡到第二次平衡,平衡移动的方向是向正向移动,可以把C 的浓度减小。将C从平衡混合物中分离出去。已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),温度升高,向正向移动,则该反应的正反应为吸热反应。△H>0
2C第III阶段,从开始至平衡,用B表示的平均反应速率为0.36mol/L.10min=0.036mol/(L·min). 由第一次平衡到第二次平衡,平衡移动的方向是向正向移动,可以把C 的浓度减小。将C从平衡混合物中分离出去。已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),温度升高,向正向移动,则该反应的正反应为吸热反应。△H>0
本题难度:一般