时间:2017-08-26 03:04:47
1、填空题 (每空1分,共10分)根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号__________。
(2)最外层电子排布为4s24p1的原子的核电荷数为__________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为:?,SO2的立体结构为:?。
(5)周期表中最活泼的非金属元素原子的轨道表示式为__________?。
( 6 ) 三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
( 7 ) 某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是__________。
( 8 )写出铬元素在周期表中的位置__________,它位于__________区。
参考答案:(1)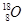 ?(1分)?(2)31 (1分)?(3)硒 (1分) (4)三角锥形(1分)、V形 (1分)
?(1分)?(2)31 (1分)?(3)硒 (1分) (4)三角锥形(1分)、V形 (1分)
(5) (1分)(6) 分子晶体 (1分)?(7) 1s22s22p63s2或[Ne]3s2 (1分)
(1分)(6) 分子晶体 (1分)?(7) 1s22s22p63s2或[Ne]3s2 (1分)
(8) 第四周期ⅥB族(1分) d(1分)
本题解析:(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,则含有8个质子,10个中子的原子的化学符号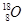 。
。
(2)最外层电子排布为4s24p1的原子的核电荷数为2+8+18+3=31。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,则其原子序数是2+8+18+6=34,所以该元素的名称是硒。
(4)H3O+中价层电子对数是4,其中氧原子含有1对孤对电子,所以分子立体结构为三角锥形;SO2分子价层电子对数是3,其中硫原子含有1对孤对电子,所以立体结构为V形。
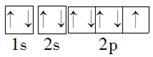
(5)周期表中最活泼的非金属元素是F元素,则其原子的轨道表示式为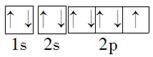 。
。
(6)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为分子晶体。
(7)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,则设最外层电子数是x,所以(10+x)÷6=x,解得x=2,因此该元素原子的电子排布式是1s22s22p63s2或[Ne]3s2。
(8)铬元素在周期表中的位置第四周期ⅥB族。区的名称来自于按照构造原理最后通入电子的轨道名称,所以铬元素位于d区。
本题难度:一般
2、选择题 下列叙述中错误的是
[? ]
A.阴、阳离子通过静电作用所形成的化学键叫做离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间不可能形成离子键
参考答案:D
本题解析:
本题难度:简单
3、选择题 氧可与许多元素形成化合物,下列有关叙述错误的是( )
A.H3O+的结构式为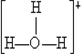
B.氧与氟形成的化合物OF2中,氧元素的化合价为-2价
C.Na2O2的电子式为![]()
D.在Mg18O晶体中,阴离子结构示意图可表示为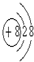
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列现象与氢键无关的是?
A.小分子的醛、羧酸可以与水互溶
B.冰的密度比液态水的密度小
C.邻羟基苯甲酸的溶沸点比对羟基苯甲酸的溶沸点低
D.乙醚与苯混溶
参考答案:D
本题解析:A、小分子的醛、羧酸可以与水互溶,是因为小分子的醛和羧酸和水分子间能形成氢键,增大分子间的作用力,正确;B、冰和水的密度不同主要是由于水分子间存在氢键,氢键在水液态是使一个水分子与4个水分子相连,而当水凝固时氢键会拉伸水分子,使水分子之间距离增大,体积也就增大了,所以冰的密度小于液态水,正确;C、邻羟基苯甲酸易形成分子内氢键,对羟基苯甲酸易形成分子间氢键,所以邻羟基苯甲酸的溶沸点比对羟基苯甲酸的溶沸点低,正确;D、乙醚与苯混溶符合相似相容原理,与氢键无关,错误,答案选D。
本题难度:一般
5、选择题 关于氢键,下列说法正确的是(? )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.分子间形成的氢键使物质的熔点和沸点升高
D.H2O是一种非常稳定的化合物,这是由于氢键所致
参考答案:C
本题解析:水分子内不形成氢键,A项错误。水蒸气中不存在氢键,B项错误。分子间氢键的形成会使分子间作用增强,熔点和沸点升高,C项正确。H2O分子稳定是共价键键能强的原因而不是氢键,D项错误。
本题难度:一般