时间:2017-08-26 03:04:47
1、填空题 (9分)下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1、02 | 2、27 | 0、74 | 1、43 | 0、77 | 1、10 | 0、99 | 1、86 | 0、75 | 1、17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
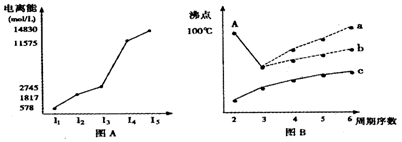
2、选择题 下列所述性质中能证明化合物微粒间一定存在离子键的是( )
A.易溶于水
B.具有较高的熔点
C.熔融状态下能导电
D.溶于水能电离出离子
3、简答题 已知A、B、C、D是原子序数依次递增的短周期元素.A元素的最外层电子数是其电子层数的两倍;B元素的最高正化合价为+5;C元素是短周期中原子半径最大的元素(稀有气体元素除外);D可形成两种氧化物甲和乙,甲能使品红溶液褪色,乙不能.请回答:
(1)写出D在周期表中的位置______;
(2)Cu与B的最高价氧化物对应水化物的稀溶液反应的化学方程式为:______.
(3)乙溶于水所得溶液中阴离子的检验方法是______.
(4)标准状况下,2.24LA的最高价氧化物与200mL1mol/LC的最高价氧化物对应水化物充分反应,离子方程式为______.
4、选择题 通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是? ( )
A.BF3和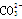 是等电子体,均为平面正三角形结构
是等电子体,均为平面正三角形结构
B.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
C.NH3和PCl3是等电子体,均为三角锥形结构
D.CH4和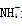 是等电子体,键角均为60°
是等电子体,键角均为60°
5、选择题 关于氢键,下列说法正确的是(?)
A.乙酸的沸点比甲酸甲酯高
B.邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点高
C.HF是一种非常稳定的化合物,这是由于氢键所致
D.冰中存在范德华力和氢键,而液态水中只存在范德华力