浓氨水呈碱性
参考答案:D
本题解析:
正确答案:D
本题综合考查化学实验以及元素化合物的相关知识。A选项,铁粉过量应该生成Fe2+,不会有红色出现;AgCl溶解度比AgI大, AgI沉淀中滴入稀KCl溶液不会有白色沉淀出现,故B错;Al箔插入浓HNO3中才会形成致密的氧化膜钝化,稀硝酸中会反应,故C错;D的实验操作、现象和结论都是正确的。
本题难度:一般
3、填空题 (14分)某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。 Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。

主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为:?;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为:?;
(3)实验小组的报告如下,请补充完整:
?
| 实验记录
| 分析或计算结果
| 现象
| 硬质管内绿色变为红棕色;
| 生成物有?
| 干燥管B中晶体白色变蓝色。
| 生成物有H2O
| 数据
| 称取绿矾样品16.68g;
| 反应的绿矾0.06mol
| 干燥管E最后增重2.24g;
| 生成SO2?mol
| C中生成白色沉淀的质量为4.66g;
| 生成DO3 0.02mol
|
?(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)
参考答案:(1)除去SO2中的H2O(或干燥)?(2分)
(2)过滤、洗涤、干燥、称量?(2分)
(3)Fe2O3?(1分)? 0.035 mol?(1分)
(4)①高温下部分SO3分解为SO2和O2?;
②干燥管E吸收了空气中的H2O和CO2气体;
③绿矾分解不完全;
④反应生成的气体未被完全吸收……
(只要答案合理均可,一条合理原因2分,共4分)
(5)增加检验SO2气体的装置,如将干燥管E换成装有品红试剂的洗气瓶等;
不必称量质量;?
在装置最后再加上一个干燥管,防止空气中的水蒸气进入干燥管E中;
加尾气吸收装置,防止空气污染……
(其他合理答案均可,一条合理建议2分,共4分)
本题解析:该实验具有一定的开放性,是试题发展的新趋势。验证生成的产物中有氧化铁、二氧化硫、三氧化硫、水,因大部分物质的验证需要经过水溶液,因此验证水放在第一位,无水硫酸铜与水反应得到五水硫酸铜,颜色有白色变为蓝色;三氧化硫通入到氯化钡溶液中将有白色沉淀生成,从而验证三氧化硫的存在;浓硫酸干燥二氧化硫,二氧化硫被碱石灰吸收,通过称重法验证二氧化硫的存在;氧化铁为红棕色,通过观察固体颜色的变化确定有氧化铁生成。
本题难度:一般
4、实验题 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时必需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
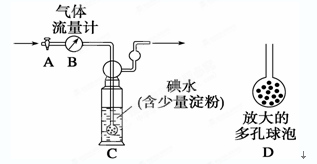
(1)洗气瓶C中导管末端连接一个多孔球泡D,其目的是______________________________。
(2)洗气瓶C中的溶液还可以用其他试剂代替,如酸性高锰酸钾溶液,你认为选择酸性高锰酸钾溶液的理由有________________________________________________________。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。若某实验小组同学测得的SO2含量总是偏低,可能的原因是__________________________________________________。(假设实验装置、测量仪器、药品和实验操作程序均合理)
【乙方案】:实验步骤如下面流程图所示:
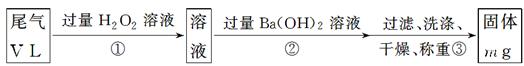
(4)写出步骤②中反应的化学方程式____________________________________________。
(5)步骤③中判断沉淀已经洗涤干净的方法是_______________________________________。
(6)实验中若通过的尾气体积为33.6L (已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该尾气中二氧化硫的含量是否达到排放标准(写出计算过程)。
参考答案:(10分)(1)增大气体与溶液的接触面积,有利于SO2与碘水充分反应(1分)
(2)酸性高锰酸钾溶液能够充分吸收SO2并与之反应,反应终了时现象易于观察(或其他合理答案)(1分)?(3)偏低?通入尾气速率过快,SO2吸收不充分(各1分)
(4)H2SO4+Ba(OH)2=BaSO4↓+2H2O(2分)
(5)取最后一次的洗涤液少许,用PH试纸测量PH值或加入Na2SO4溶液,看是否有浑浊出现(或其他合理答案)(2分)
(6)由硫守恒可知n(SO2)=n(BaSO4)="0.001" mol,得到SO2的体积分数为0.067%大于0.05%,未达标(2分)
本题解析:(1)多孔球泡D能增大气体与溶液的接触面积,有利于SO2与碘水充分反应。
(2)因为酸性高锰酸钾溶液具有强氧化性,能够充分吸收SO2并与之反应,且酸性高锰酸钾溶液显紫红色,反应终了时现象易于观察。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则导致通过的气体偏多,因此测得的SO2含量偏低。测得的SO2含量总是偏低,可能的原因是通入尾气速率过快,SO2吸收不充分引起的。
(4)双氧水具有氧化性,能把SO2氧化生成硫酸,所以反应②的化学方程式是H2SO4+Ba(OH)2=BaSO4↓+2H2O。
(5)步骤③中判断沉淀已经洗涤干净的方法可以是沉淀法,也可以通过测量溶液的pH值,即取最后一次的洗涤液少许,用PH试纸测量PH值或加入Na2SO4溶液,看是否有浑浊出现(或其他合理答案)。
(6)最终所得固体是硫酸钡,其质量为0.233g,物质的量是0.233g÷233g/mol=0.001mol。又因为尾气的物质的量是33.6L÷22.4L/mol=1.5mol
所以该尾气中二氧化硫的含量是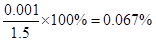
即SO2的体积分数大于0.05%,未达标2尾气吸收的综合性实验判断
点评:该题是中等难度的试题,也是高考中的常见考点,试题综合性强,侧重能力的培养和实验设计能力的训练,难度较大,学生不易得分。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
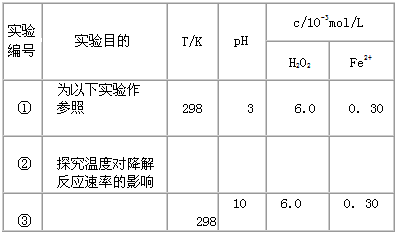
5、实验题 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p - CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
[数据处理] 实验测得p - CP的浓度随时间变化的关系如下图。
|