时间:2017-08-26 01:59:04
1、选择题 欲迅速除去铝壶底的水垢,最好的办法是用( )
A.浓盐酸
B.稀硝酸
C.浓硫酸
D.浓硝酸
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列实验中,仪器选择正确、能达到实验目的是
A.测定食醋的浓度
B.减压过滤Al(OH)3胶状沉淀
C.分离碘酒中的碘和酒精
D.合成乙酸乙酯
参考答案:D
本题解析:分析:A.NaOH应放在碱式滴定管中;
B.胶体粒子能透过滤纸;
C.碘易溶于水酒精;
D.实验装置符合制备方法.
解答:A.NaOH溶液腐蚀玻璃,应放在碱式滴定管中,故A错误;
B.胶体粒子能透过滤纸,应用渗析的方法分离,故B错误;
C.碘易溶于水酒精,不能用分液的方法分离,故C错误;
D.乙醇和乙酸在浓硫酸作用下加热可制备乙酸乙酯,用饱和碳酸钠溶液吸收,实验装置符合,故D正确.
故选D.
点评:本题考查较为综合,题目侧重于酸碱中和滴定、物质的分离和制备等实验基本操作的考查,题目难度不大.
本题难度:困难
3、选择题 某同学设计如下实验,测量m克铜银合金样品中铜的质量分数: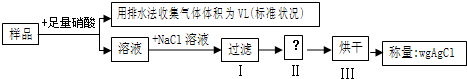
下列说法中错误的是
A.收集到的V?L气体为?NO
B.若缺少操作Ⅱ,会导致实验结果偏小
C.被铜银合金还原的硝酸可能为?
D.依据m、V不能确定铜的质量分数
参考答案:D
本题解析:分析:A、由流程图可知,实验用排水法收集气体,二氧化氮能与水反应生成NO,故金属与硝酸反应生成气体不能是NO或NO2或NO、NO2,最后收集的气体为NO;
B、由流程图可知,溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止测定的氯化银的质量增大;
C、被还原的硝酸全部生成为NO,计算NO的物质的量,再根据N原子转移守恒计算被还原的硝酸;
D、由流程图可知,实验原理为,在反应后溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量.
解答:A、由流程图可知,实验排水法收集,二氧化氮能与水反应生成NO,故金属与硝酸反应生成气体不能是NO或NO2或NO、NO2,最后收集的气体为NO,故A正确;
B、由流程图可知,溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止测定的氯化银的质量增大,导致合金中银的质量增大,铜的质量偏小,测量铜的含量偏低,故B正确;
C、生成的气体是NO,物质的量为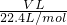 =
=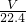 mol,根据原子转移守恒可知被还原的硝酸为
mol,根据原子转移守恒可知被还原的硝酸为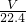 mol,故C正确;
mol,故C正确;
D、氯化银的质量为wg,利用Ag守恒计算合金中银的质量,合金质量减去Ag的质量为Cu的质量,可以确定Cu的质量分数,故D错误;
故选D.
点评:本题考查学生对实验原理的理解、物质组成的测定等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.
本题难度:困难
4、填空题
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度来看,不恰当的一种物质是_______。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出其中能产生气体的离子方程式为______________________。选取日常生活中常见物质由纯碱制烧碱的化学方程式为______________ 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是______。
A.Ag B.Cu C.Al D.Fe
(4)烧碱、纯碱均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,
①分别是:________;Na2CO3;__________;NaHCO3。
②将得到的固体重新溶解于水,在溶液中加盐酸,使溶液中只含一种溶质,再将溶液蒸干,得到固体的物质的量是__________摩。
参考答案:(1)纯碱(或Na2CO3)
(2)CO32-+2H+===CO2↑+H2O;Ca(OH)2+Na2CO3=== Ca CO3↓ +2NaOH
(3)AB
(4)①NaOH和Na2CO3;Na2CO3和NaHCO3
(5)0.05
本题解析:
本题难度:一般
5、填空题 在浓硝酸中放入铜片:
(1)开始时反应的化学方程式为________________, 实验现象为___________。
(2)若铜有剩余,则反应将要结束时的化学方程式为________________。
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;溶液逐渐变蓝,有红棕色气体逸出
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)加入稀H2SO4后,H+与原溶液中的NO3-构成强氧化性的条件,又能与过量的Cu反应,发生反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
本题解析:
本题难度:一般