时间:2017-08-26 01:59:04
1、选择题 1L稀H2SO4和稀HNO3的混合液,其物质的量浓度分别为0.4mol?L-1和0.1mol?L-1.若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A.2.4g
B.3.2g
C.6.4g
D.9.6g
参考答案:1L稀H2SO4和稀HNO3的混合液,其物质的量浓度分别为0.4mol?L-1和0.1mol?L-1,
则n(H+)=1L×2×0.4mol/L+1L×0.1mol/L=0.9mol,
n(NO3-)=1L×0.1mol/L=0.1mol,
发生3Cu+8H++2NO3-=3Cu2++2NO+4H2O
3 8 2
0.9mol0.1mol
可知H+过量,NO3-完全反应,
则消耗铜的质量为3×0.1mol2×64g/mol=9.6g,
故选D.
本题解析:
本题难度:一般
2、选择题 下列各组物质中,因反应条件、用量、浓度等不同而发生不同化学反应的是( )
①Cu与硝酸;②SO2与NaOH溶液;③AlCl3溶液与KOH溶液;④CO2与Na2SiO3溶液;⑤Zn和硫酸;⑥SO2和H2S.
A.除②外
B.除⑥外
C.除⑤外
D.全部
参考答案:B
本题解析:
本题难度:一般
3、选择题 如图是三种稀酸对Fe?Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是 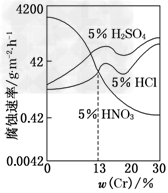
[? ]
A.稀硝酸对Fe?Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)===Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe?Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe?Cr合金的腐蚀性减弱
参考答案:D
本题解析:
本题难度:一般
4、选择题 如图所示,向一定量的铁粉中加入一定体积12mol/L的HNO3,加热充分反应后,下列粒子在体系中一定大量存在的是( )
①NO3- ②Fe3+ ③H+ ④NO ⑤NO2.
A.①
B.①⑤
C.②④⑤
D.①②③⑤
参考答案:随反应的进行,硝酸浓度会变低,铁与稀硝酸反应生成NO,硝酸过量时生成三价铁,铁过量时,生成亚铁离子,
若铁粉过量,体系中大量存在NO3-、Fe2+、H+、NO;
若HNO3过量,体系中大量存在NO3-、Fe3+、H+、NO,
故选:B;
本题解析:
本题难度:一般
5、选择题 “酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
A.抑制Fe2+的水解,用稀硝酸酸化
B.提高高锰酸钾的氧化能力,用盐酸酸化
C.确认溶液中含有SO42-时,用盐酸酸化,再检验
D.检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化,再检验
参考答案:C
本题解析:
本题难度:简单