时间:2017-08-26 01:55:02
1、选择题 下列电离方程式正确的是(?)
A.H3PO4 3H++
3H++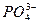
B.CaCO3 Ca2++
Ca2++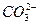
C.NaHS Na++H++S2-
Na++H++S2-
D.2H2O H3O++OH-
H3O++OH-
参考答案:D
本题解析:A选项中H3PO4为多元弱酸,电离方程式应分步书写;B选项CaCO3是盐,作为强电解质应完全电离;C选项中HS-不能拆,应书写为NaHS====Na++HS-;D选项为H2O的电离方程式,也可写为H2O H++OH-。
H++OH-。
本题难度:简单
2、填空题 (1)某温度下纯水的c(H+)=2.0×10-7mol/L。在此温度下,某溶液中由水电离出的c(H+)为4.0× 10-13 mol/L,则该溶液的pH可能是____。
(2)分别将少量CO2气体通入一元酸的钠盐NaA和NaB的溶液中,发生的反应为:
①CO2+2NaA+ H2O==Na2CO3+2HA;
②CO2+NaB+H2O==NaHCO3+HB,
试由此推断H2CO3、HCO3-、HA、HB 的电离程度由大到小顺序为___。
(3)已知在相同条件下,HCN的电离程度比HF小。请根据有关知识分析判断,在相同温度下,物质的量浓 度相同的NaCN溶液和NaF溶液中: [c(CN-)+c(OH-)]____[f(F-)+c(OH-)]
(选填“等于”、“大于”或“小于”)。
参考答案:(1)1或 12.4(即l3-lg4)
(2)H2CO3>HB>HCO3->HA
(3)等于
本题解析:
本题难度:一般
3、选择题 某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是
A.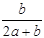 ×100%
×100%
B. ×100%
×100%
C.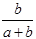 ×100%
×100%
D.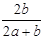 ×100%
×100%
参考答案:A
本题解析:电离度是指弱电解质已电离的物质的物质的量与弱电解质原来的物质的量之比。
HA? ?H+?+? A-
?H+?+? A-
起始n: (a+b/2)mol? 0? 0
变化n:? b/2mol? b/2mol? b/2mol
平衡n:? amol? b/2mol? b/2mol
因此,HA的电离度(即转化率)是: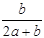 ×100%
×100%
本题难度:一般
4、选择题 在一定温度下,甲、乙二瓶醋酸溶液分别为:500 mL 0.01 mol/L和50 mL 0.1 mol/L,下列各项比较错误的是
[?]
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列关于电解质溶液的判断正确的是(?)
A.60℃时,NaCl溶液的pH<7,则溶液呈酸性
B.将pH=4的CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小
C.常温下,CH3COOH分子可能存在于pH>7的碱性溶液中
D.相同温度下,1 mol·L-1氨水与0.5 mol·L-1氨水中c(OH-)之比是2∶1
参考答案:C
本题解析:NaCl是强酸强碱盐,溶液始终显中性。A项错误。在整个稀释过程中,氢离子的物质的量一直是增大的,但氢离子浓度是先增大后减小,Kw=[H+][OH-]在一定温度下是一个定值,所以OH-浓度增大。B项错误。CH3COOH是弱酸,醋酸盐溶液中,CH3COO-+H2O CH3COOH+OH-就有CH3COOH分子存在。C项正确。NH3·H2O是弱碱,不同浓度下电离程度不同。D项错误。
CH3COOH+OH-就有CH3COOH分子存在。C项正确。NH3·H2O是弱碱,不同浓度下电离程度不同。D项错误。
本题难度:一般