时间:2017-08-26 01:54:18
1、填空题 (18分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。? ’?
①已知25℃.10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1)?△H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l ?则反应2SO2(g)+O2(g)? 2SO3(g)的△H=?kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能?(填“增大”、“不变”或“减小”)。
?则反应2SO2(g)+O2(g)? 2SO3(g)的△H=?kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能?(填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为?mol,此反应的化学方程式是?。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:
V2+-e一=V3+。
①电池放电时的总反应方程式为?。
充电时,电极M应接电源的?极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)?(填“增大”、“不变”或“减小”),阳极的电极反应式为:?。
参考答案:(18分)
(1)①—197(2分)?减小(2分)
② 4(2分)? 2SO2+SeO2+2H2O=2H2SO4+Se(2分)
(2)①VO2++V2++2H+=VO2++V3++H2O(3分) 正极(2分)
②减小(2分) VO2++ H2O—e?= VO2++2H+(3分)
本题解析:(1)①根据盖斯定律,2SO2(g)+O2(g) 2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
②Se元素由+4价降低为0,所以当有79gSe生成时,转移转移电子的物质的量为:79g÷79g/mol×4=4mol;根据氧化还原反应规律,SO2、SeO2、H2O反应生成H2SO4和Se,配平可得化学方程式:2SO2+SeO2+2H2O=2H2SO4+Se
(2)①根据电池结构图,正极上VO2+得电子生成VO2+,所以放电时的总反应方程式为:VO2++V2++2H+=VO2++V3++H2O;电极M为电池的正极,充电时应接电源的正极。
②第一步VO2+转化为V3+的电解方程式为:VO2++4H++2e?= V3++2H2O,消耗了H+,所以阴极区溶液n(H+)减小;阳极上VO2+失电子生成VO2+,所以电极方程式为:VO2++ H2O—e?= VO2++2H+。
本题难度:一般
2、选择题 如图,有关零排放车载燃料电池叙述正确的是(?)
A.正极通入H2,发生还原反应
B.负极通入H2,发生还原反应
C.导电离子为质子,且在电池内部由正极定向移向负极
D.总反应式为2H2+O2 = 2H2O
参考答案:D
本题解析:在燃料电池中,通入燃料H2的电极为负极。负极发生氧化反应。通入空气或氧气的电极为正极,正极发生还原反应。在电解质溶液中,根据同种电荷相互排斥,异种电荷相互吸引的原则,由于是酸性介质,所以导电离子质子向负电荷较多的正极移动。该燃料电池的总反应式为2H2+O2 = 2H2O。因此正确选项为D。
本题难度:一般
3、选择题 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是( )
A.电池工作时,正极反应式为:O2+2H2O+4e-═4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02gH2时,b极周围会产生0.04gH2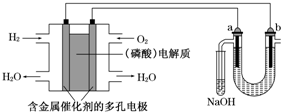
参考答案:B
本题解析:
本题难度:简单
4、填空题 (13分)(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_________________,发生 反应(填氧化或还原);电子从 经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为 ,溶液中Fe3+向 (填“负极”或“正极”)迁移,负极反应式为 ;正极反应式为 。
参考答案:(1)2H++2e-=H2↑ 还原 锌 铜 正极
(2)Cu、正、 Cu-2e-=Cu2+ 2Fe3+ +2e- = 2Fe2+
本题解析:(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中形成原电池,该原电池中锌是负极,发生氧化反应,铜是正极,溶液中的氢离子得电子生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑;外电路上,电子从负极沿导线到正极,即电子是从锌经外电路到铜;溶液中H+ 向正极移动。(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,铜的化合价由0价升高为+2价,发生氧化反应,作原电池的负极,电极反应式为Cu-2e-=Cu2+;电解质溶液中阳离子Fe3+向正极迁移,在正极上发生还原反应,电极反应式为2Fe3+ +2e- = 2Fe2+。
考点:考查原电池原理、电极方程式书写。
本题难度:一般
5、选择题 15.把锌片和铁片放在盛有稀食盐水和K3[Fe(CN)6]试液混合溶液的培养皿中(如图所示平面图),经过一段时间后,下列说法中正确的是
A.Ⅰ附近溶液pH降低
B.Ⅱ附近很快出现蓝色沉淀
C.Ⅲ附近产生黄绿色气体
D.Ⅳ附近很快生成铁锈
参考答案:B
本题解析:第一个图示是电解池,铁做阳极,铁失电子生成亚铁离子,锌做阴极,在阴极上,2H++2e-=H2↑,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅰ附近溶液pH增大,;K3[Fe(CN)6]叫赤血盐,[Fe(CN)6]3-是络离子相对稳定,一般的化学反应不会破坏, [Fe(CN)6]3- + Fe2+ ="==" Fe[Fe(CN)6]-,后一种物质的钾盐是颜色特别深的蓝色沉淀,叫做普鲁士蓝,因此Ⅱ附近出现蓝色沉淀;第二个图示是原电池,锌做负极,锌失电子形成锌离子,无黄绿色气体生成,同时Fe被保护起来,不会迅速生锈。
考点:电解池、原电池
点评:本题有一定难度,但是关键是要弄清楚原电池和电解池的差别,再进一步进行判断。
本题难度:一般