时间:2017-08-26 01:44:25
1、选择题 对0.1 mol·L-1的醋酸溶液进行以下操作,下列分析判断正确的是()
A.加入少量0.1 mol·L-1的硫酸,水电离产生的c(H+)减小
B.升高温度,溶液的pH会增大
C.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+)
2、选择题 下列说法正确的是
A.常温下,某溶液中由水电离的C(OH-)=10-3 mol/L,则该溶液可能为NH4Cl或NaOH溶液
B.常温时浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离的C(OH-)前者大于后者
C.1 mL PH=1的H2SO4与100 mLNaOH溶液混合后PH=7,则原NaOH溶液PH=11
D.25℃时PH=5的CH3COOH溶液和100℃时PH=5的AlCl3溶液C(H+)相等
3、填空题 (7分)已知:A酸的溶液pH=a,B碱的溶液pH="b?"
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=?。酸碱按体积比为1:10混合后溶液显中性,则a+b=?。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为?mo1·L–l,B溶液中水电离出的氢离子浓度为?mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA ??VB,混合后溶液中的离子浓度关系为c(Na+)??c(CH3COO—)。?
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为??。
4、实验题 (12分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
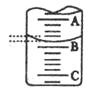
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
5、选择题 在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) + 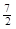 O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1
O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1
B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g)△H =-1560kJ·mol-1
C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l)△H =+3120 kJ·mol-1
D.C2H6(g) +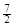 O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1
O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1