时间:2017-08-26 01:44:25
1、选择题 向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的CH3COOH溶液,其pH逐渐减小,图中a,b,c三点的pH为实验中所测得,下列有关说法中一定正确的是( )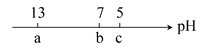
A.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.当pH=7时,所加CH3COOH溶液的体积为10 mL
C.当5<pH<7时,溶液中c(CH3COO-)>c(Na+)
D.继续滴加0.1 mol·L-1的CH3COOH溶液,溶液的pH最终可以变化至1
参考答案:C
本题解析:最初向NaOH溶液中滴加极少量的CH3COOH溶液时,可能有c(OH-)>c(CH3COO-),故A项错误;当滴加10 mL CH3COOH溶液时,与NaOH溶液恰好完全反应,此时pH>7,B项错误;无限滴加CH3COOH溶液,相当于在0.1 mol·L-1的CH3COOH溶液中滴加少量NaOH溶液,pH一定大于1,D项错误。
本题难度:一般
2、选择题 常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是
A.②中由水电离出的c(H+)=1×10-12mol/L
B.将①、③混合,若有pH=7,则消耗溶液的体积:③>①
C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L
D.将四份溶液均稀释10倍后溶液pH:③>④,②<①
参考答案:D
本题解析:由于CH3COOH为弱电解质,故0.01 mol/L CH3COOH溶液中的c(H+)≠1×10-2mol/L,故由水电离出的c(H+)≠1×10-12mol/L,A项错误;因pH=12的氨水中氨水的浓度远大于0.01 mol/L,0.01 mol/L HCl与pH=12的氨水混合,当pH=7时,消耗溶液的体积:③<①,B项错误;将②、④等体积混合,溶液的总体积增大,c(CH3COO-)+c(CH3COOH)<0.01 mol/L,C项错误。0.01 mol/L HCl稀释10倍后pH=3。CH3COOH是弱酸稀释电离平衡右移,所以0.01 mol/L的CH3COOH稀释10倍后pH<3,D项正确。
本题难度:一般
3、选择题 1mol可燃物完全燃烧生成稳定的氧化物所放出的热为燃烧热.下列燃烧反应的反应热不是燃烧热的是( )
①H2(g)+
| 1 2 |
| 1 2 |
参考答案:①H2(g)+12O2(g)═H2O(l)△H1,符合燃烧热的定义,故正确;
②C(s)+12O2(g)═CO(g)△H2,生成产物不是稳定氧化物,故错误;
③S(s)+O2(g)═SO2(g)△H3,符合燃烧热的定义,故正确;
④2H2S(g)+3O2(g)═2SO2(s)+2H2O(l)△H4,可燃物的物质的量不是1mol,△H4所以不是燃烧热,故错误;所以错误的是②④;
故选:D.
本题解析:
本题难度:一般
4、选择题 某化学兴趣小组同学探索某些溶液的酸碱性。25℃时他们分别测得CH3COOH和(NH4)2SO4两种溶液的pH都为4,并对结果作了以下四种分析。则其中正确的是 (?)
A.(NH4)2SO4溶液呈酸性是因为NH4+电离出H+
B.因为醋酸是弱酸,所以醋酸促进了水的电离
C.CH3COOH和(NH4)2SO4溶液中水电离出来的H+的物质的量浓度相等
D.CH3COOH和(NH4)2SO4两水溶液呈酸性的原因不同
参考答案:D
本题解析:25℃时分别测得CH3COOH和(NH4)2SO4两种溶液的pH都为4,
A.(NH4)2SO4溶液呈酸性是因为NH4+水解结合了水电离出来的氢氧根,所以水电离的H+就留在了溶液中,所以显碱性。
B.因为醋酸是弱酸,醋酸抑制了水的电离;
C.CH3COOH和(NH4)2SO4溶液中水电离出来的H+的物质的量浓度不相等,前者是酸,抑制了水的电离,后者有弱离子铵根,促进了水的电离;
D.CH3COOH和(NH4)2SO4两水溶液呈酸性的原因不同 ,正确,故选D。
点评:影响水电离的因素
1.温度。升温总是促进水的电离
2.酸,碱。强酸强碱(强电解质)总是抑制水的电离,弱酸弱碱(弱电解质)也抑制水的电离。
3.能水解的盐,盐类(除酸式盐之外)总是促进水的电离,
4.活泼金属。因为活泼金属总是与水店里出的氢离子反应,使氢离子浓度减小,所以总是促进水的电离。
本题难度:一般
5、填空题 (8分)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=?。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=?。
(3)该温度下,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a和b之间应满足的关系是?。(列出含a、b的式子)
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因?。
参考答案: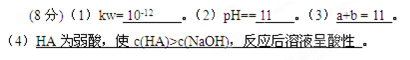
本题解析:(1)该温度下,水的离子积常数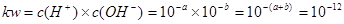 ;
;
(2)100mL0.1mol/L的稀硫酸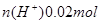 ;100mL0.4mol/L的NaOH溶液
;100mL0.4mol/L的NaOH溶液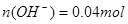 ;混合后,溶液中氢氧根离子过量,剩余物质的量为:
;混合后,溶液中氢氧根离子过量,剩余物质的量为: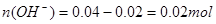 ;则
;则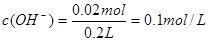 ,即
,即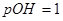 ,
,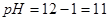 ;
;
(3)混合后溶液呈中性即酸与碱恰好完全反应,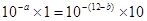 ,得
,得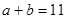 ;
;
(4)pH=2的某酸HA溶液和pH=10的NaOH溶液中氢离子浓度与氢氧根离子浓度相等,等体积混合溶液显酸性,即可得HA为弱酸;
本题难度:一般