时间:2017-08-26 01:31:37
1、选择题 下列事实能说明氯元素的非金属性比硫元素强的是( )
①还原性:Cl-<S2-
②Cl2能与H2S反应生成S
③HClO4的酸性比H2SO4的强
④常温下Cl2是气体,S是固体.
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:①还原性:Cl-<S2-,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
②Cl2能与H2S反应生成S,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
③HClO4的酸性比H2SO4的强,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
④常温下Cl2是气体,S是固体,为物理性质,不能比较非金属性,
故选A.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.在元素周期表中,每个纵列的价电子层的电子总数一定相等
B.在元素周期表中,s区,d区和ds区的元素都是金属
C.可能存在核外电子排布为1s22s22p63s23p64s24p1的原子
D.在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区空间出现概率的大小
参考答案:D
本题解析:
本题难度:简单
3、选择题 有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子。有关判断不正确的是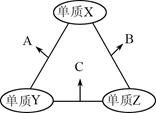
A.X元素位于ⅥA族
B.A不能溶解于B中
C.B的沸点高于C的沸点
D.A和C不可能发生氧化还原反应
参考答案:D
本题解析:试题分析:B和C均为10电子分子,考虑为氢化物,由转化关系可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,原子半径Y>X,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素,由转化关系,单质X、Y反应生成A,单质Y、Z生成B,则Y应为氮元素、X应为氧元素,则A为NO、B为H2O、C为NH3,验证符合转化关系,A.X为氧元素,处于ⅥA族,故A正确;B.NO不溶于水,故B正确;C.常温下,水为液体,氨气为气态,水的沸点更高,故C正确;D.氨气与NO可以发生反应生成氮气与水,故D错误;故选D.
考点:本题考查元素及无机物的推断、元素化合物性质等,难度中等,推断元素与物质是解题的关键,注意掌握常见10电子物质,利用猜测验证法进行推断.
本题难度:简单
4、选择题 根据中学化学教材所附元素周期表判断,下列叙述不正确的是
[? ]
A.若周期表中第七周期完全排满共有32种元素
B.周期表中共有18个列,其中形成化合物种类最多的在第14列
C.除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
D.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
参考答案:C
本题解析:
本题难度:简单
5、推断题 Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
参考答案:(1)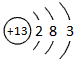
(2)弱于
(3)S + 2H2SO4(浓)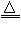 3SO2↑+ 2H2O
3SO2↑+ 2H2O
(4)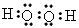 ?
?
(5)NaNO2
(6)(3a-4b)KJ/mol
本题解析:
本题难度:一般