时间:2017-08-26 01:23:15
1、选择题 实验室现有3种酸碱指示剂,其pH变色范围如下甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0 用
0.10 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
[? ]
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
参考答案:D
本题解析:
本题难度:一般
2、选择题 如图曲线a和b是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是
[? ]
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
参考答案:B
本题解析:
本题难度:一般
3、简答题 今欲用NaOH固体配制250mL?0.2mol/L的NaOH溶液.
(1)某同学配制过程中移液操作如图,其中可见两处错误:①______?②______
(2)用______(填滤纸或小烧杯)在托盘天平上称取______?NaOH固体.
(3)配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.
(4)以下因素会造成实验结果偏低的是______
A.容量瓶中原来有少量蒸馏水?B.定容时观察液面俯视
C.忘记洗涤?D.定容时观察液面仰视.
参考答案:(1)配制过程中应通过玻璃棒引流,防止液体洒落,容量瓶的规格为100mL,与配制溶液的体积不一致,故答案为:未用玻璃棒引流;容量瓶的规格与配制溶液的体积不一致;
(2)由于氢氧化钠具有腐蚀性,所以要放到烧杯中称量,m(NaOH)=nM=cvM=0.5mol/L×0.1L×40mol/mol=2.0g,故答案为:小烧杯;2g;
(3)因容量瓶不能存放溶液,所以配制好的溶液不能长期存放在容量瓶中,故答案为:不能;
(4)A.容量瓶中原来有少量蒸馏水,对溶液的体积无影响,浓度不变,故A错误;
B.定容时观察液面俯视,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故B错误;
C.忘记洗涤,因烧杯和玻璃棒上占有溶质,溶质的质量偏少,浓度偏低,故C正确;
D.定容时观察液面仰视,溶液的液面高于刻度线,溶液的体积偏大,浓度偏低,故D正确;
故答案为:CD.
本题解析:
本题难度:一般
4、简答题 某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.实验步骤如下,回答下列问题:
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用______量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测.
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、______、正式装液,排除气泡并调节液面.
(3)若用测定溶液pH的方法来确定滴定的终点,则应用______测定锥形瓶中溶液的pH,临近滴定终点时应注意______.
(4)滴定过程中,锥形瓶中溶液的pH变化如下
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 pH 13.1 12.6 12.2 11.7 11.4 9.9 7.0 4.0 2.7 2.4 1.9 |
| 指示剂 | 变色范围 (pH) | 各范围内颜色 前 中间 后 甲基橙 3.1~4.4 红 橙色 黄 石蕊 5.0~8.0 红 紫色 蓝 酚酞 8.2~10.0 无 粉红 红 | ||
参考答案:(1)滴定时,氢氧化钠溶液使用碱式滴定管盛取,故答案为:碱式滴定管;
(2)滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面,
故答案为:用待装液润洗;
(3)若用测定溶液pH的方法来确定滴定的终点,pH计是用来测量溶液pH的仪器,能较方便准确地测定溶液的pH,在滴定终点附近溶液的pH会出现突变,所以此时需每滴一滴测一次
故答案为:pH计;每滴一滴测一次;
(4)根据表中数据可以绘制出中和滴定的曲线为: ,
,
故答案为: ;
;
(5)依据图象和图表数据分析可知pH突变是4.0~9.9,盐酸和氢氧化钠恰好反应生成的氯化钠溶液呈中性,甲基橙变色范围为3.1-4.4,酚酞pH变色范围为8.2~10.0,甲基橙和酚酞都可以用作指示剂;由于石蕊变色时不容易判断,一般不选作指示剂;
滴定结束前,溶液为碱性,溶液颜色为红色,滴定结束时有粉红色变成无色,所以滴定终点的现象是溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色),
故答案为:甲基橙或酚酞;溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色);
(6)氢氧化钠溶液的浓度为:0.1000mol/L×0.024L0.02L=0.1200mol/L,
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g,
故样品中,NaOH的质量百分含量为:4.800g5.000g×100%=96%,
滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,导致消耗的标准液体积偏大,测定结果偏大,
答案为:96%;偏大.
本题解析:
本题难度:一般
5、选择题 下列图示与对应的叙述不相符的是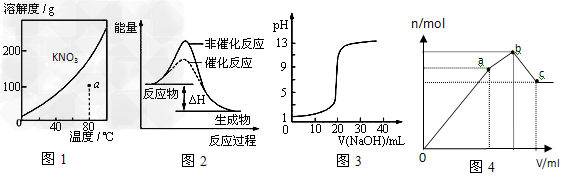
[? ]
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1醋酸溶液得到的滴定曲线
D.图4?表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
参考答案:C
本题解析:
本题难度:一般