时间:2017-08-26 01:11:50
1、简答题 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.
若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁:
①a电极材料为______,其电极反应式为______.
②电解液d可以是______(填编号)
A.纯水?B.NaCl?溶液?C.NaOH溶液?D.CuCl2溶液
③液体c为苯,其作用是______;在加入苯之前,对d溶液进行加热处理的目的是______.
④为了在短时间内看到白色沉淀,可以采取的措施是______.
A.改用稀硫酸做电解液?B.适当增大电源电压
C.适当缩小两电极间距离?D.适当降低电解液温度.
参考答案:①制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
②纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2,
则电解液b可选择BC,故答案为:BC;
③苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气,
故答案为:隔绝空气防止氢氧化亚铁被氧化;排尽溶液中的氧气,防止生成的氢氧化亚铁在溶液中被氧化;
④短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC.
本题解析:
本题难度:一般
2、填空题 冶炼金属常用以下几种方法:
A.以C、CO或H2做还原剂;?B.热分解法;
C.利用铝热反应原理还原;?D.电解法.
下列金属各采用哪种方法还原最佳.(用序号填写下列空白.)
(1)Fe、Zn、Cu等金属______;?(2)Na、Mg、Al等金属______;
(3)Hg、Ag等金属______;?(4)V、Cr、Mn、W等高熔点金属______.
参考答案:(1)由Fe、Zn、Cu等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼,故答案为:A;
(2)Na、Mg、Al等活泼或较活泼金属的化合物与C、CO或H2等不反应,故采用电解法冶炼制备,故答案为:D;
(3)Hg、Ag等不活泼金属的氧化物不稳定,受热易分解,故采用热分解法冶炼,故答案为:B;
(4)V、Cr、Mn、W等高熔点金属可利用铝热反应产生的高温来冶炼,故答案为:C;
本题解析:
本题难度:一般
3、选择题 下列关于工业生产说法不正确的是( )
A.电解精炼铜时,用粗铜做阴极,纯铜做阳极
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在炼铁工业,需要的原料有铁矿石、焦炭、空气、石灰石等
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
参考答案:A
本题解析:
本题难度:简单
4、选择题 下图为电解饱和食盐水的简易装置,下列有关说法正确的是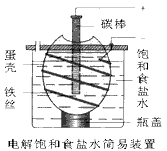
[? ]
A.电解一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕 的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列说法正确的是( )
A.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全
B.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
C.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
D.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
参考答案:A
本题解析:
本题难度:简单