时间:2017-08-26 01:11:50
1、填空题 近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。已知
① 2CH4 (g) + 3O2 (g) =2CO (g) + 4H2O(l) △H1 = -1214.6 KJ/mol
② 2CO (g) + O2(g) = 2CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2O2 (g) = CO2(g) + 2H2O (l) 的△H =_____________。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10OH-― 8e-=CO32-+ 7H2O;通入O2的一极,其电极反应式是________________________。
(3)若用石墨做电极电解500ml饱和食盐水,写出电解反应的离子方程式为:__________________;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH=______________________。
(4)将不同量的CO(g) 和H2O(g) 分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g) +H2O(g)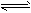 CO2(g) +H2(g),得到如下三组数据
CO2(g) +H2(g),得到如下三组数据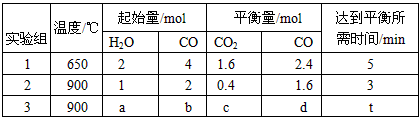
① 实验1中以υ(H2) 表示的反应速率为__________________。
② 实验2中的平衡常数是________________(计算结果保留两位小数)。
③ 该反应的正反应为______________(填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是
__________________ (用含a、b的数学式表示)。
参考答案:(1)-890.3KJ/mol
(2)O2+ 4e-+2H2O==4OH-
(3)2Cl-+2H2O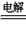 H2↑+Cl2↑+2OH-;13
H2↑+Cl2↑+2OH-;13
(4)① 0.16 mol / (L·min);② 0.17;③ 放;④ b=2a
本题解析:
本题难度:困难
2、选择题 下列金属的冶炼中,通常是用加热分解的方法来完成的是( )
A.Na
B.Mg
C.A1
D.Ag
参考答案:D
本题解析:
本题难度:简单
3、填空题 甲、乙两池的电极材料都是铁棒与碳棒(如下图)。请回答下列问题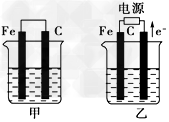
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒。
②在乙池中阴极的电极反应式是?_________________________________。
?(2)若两池中均盛放饱和NaCl溶液,反应一段时间后:
①写出乙池中发生的总反应的离子方程式?___________________________
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为________________________________
③若乙池转移0.02?mol电子后停止实验,池中溶液的体积是200?mL,则溶液混匀后的pH=
________。
参考答案:(1)①碳(C);铁(Fe);②Cu2++2e-===Cu
(2)①2Cl-+2H2O 2OH-+H2↑+Cl2↑;②5Cl2+I2+6H2O===10HCl+2HIO3;③13
2OH-+H2↑+Cl2↑;②5Cl2+I2+6H2O===10HCl+2HIO3;③13
本题解析:
本题难度:一般
4、填空题 电镀和电解精炼的原理来源于电解,但与通常意义上的电解又有所不同。
(1)电镀时,须用镀层金属作_______极,镀件作______极,电镀液中含有____。 电镀过程中,电镀液中金属离子浓度理论上保持不变。
(2)电解精炼制高纯度金属时,须用粗金属作________极,纯金属作____________极,电解液中含该金属的离子。
参考答案:
(1)阳;阴;镀层金属离子
(2)阳;阴
本题解析:
本题难度:一般
5、简答题 合理、高效利用金属矿物,将其中的金属从其化合物中还原出来用于生产和制造各种金属材料,这一过程在工业上称为金属的冶炼.
(1)以HgO为原料冶炼Hg,冶炼方法是______.
(2)铝热法是冶炼金属的方法之一,写出铝热法炼铁(Fe2O3)的化学方程式:______.引发铝热反应的实验操作是:______.
(3)某些金属氧化物粉末和铝粉在一定条件下可以发生铝热反应.下列反应速率(υ)和温度(T)的关系示意图中与铝热反应最接近的是:______(填字母).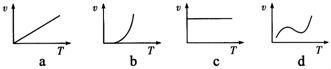
参考答案:(1)因Hg是不活泼金属,故用加热HgO分解得到Hg;
(2)根据铝热法冶炼金属的原理:金属氧化物与铝反应得到金属和氧化铝,所以铝和Fe2O3反应的化学方程式为:
2Al+Fe2O3?高温?.?Al2O3+2Fe,引发铝热反应的操作为加少量KClO3,插上Mg条并将其点燃.
(3)因通过加热引发铝热反应,所以开始速率为O,一旦反应,反应放热,温度升高,化学反应速率增大.
故答案为:(1)加热分解法;
(2)2Al+Fe2O3?△?.?Al2O3+2Fe;?加少量KClO3,插上Mg条并将其点燃;?
(3)b;
本题解析:
本题难度:一般