时间:2017-08-26 01:07:47
1、选择题 下列元素中,不属于主族元素的是
A.钾
B.铁
C.碘
D.硅
参考答案:B
本题解析:试题分析:铁是第Ⅷ族元素,不是主族元素,其余选项都是主族元素,答案选B。
考点:考查主族元素的判断
点评:该题是基础性试题的考查,试题基础性强。难度不大,该题的关键是记住周期表的结构,然后灵活运用即可。
本题难度:简单
2、选择题 在通常条件下,下列各组物质的性质排列正确的是( )
A.熔点:CO2>KCl>SiO2
B.水溶性:HCl>H2S>SO2
C.沸点:乙烷>戊烷>丁烷
D.热稳定性:HF>H2O>NH3
参考答案:A.不同晶体的熔点:原子晶体>离子晶体>分子晶体,则SiO2>KCl>CO2,故A错误;
B.H2S微溶于水,而HCl和SO2都易溶于水,故B错误;
C.相对分子质量越大,分子间作用力越大,则烷烃的沸点越高,则有戊烷>丁烷>乙烷,故C错误;
D.非金属性:F>O>N,元素的非金属性越强,氢化物的稳定性越大,则热稳定性:HF>H2O>NH3,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 性质递变规律中不正确的是( )
A.离子半径:K+>Na+>O2->F-
B.酸性:H2CO3<H3PO4<H2SO4<HClO4
C.熔点:Al>Na>K>Rb
D.热稳定性:SiH4<PH3<NH3<H2O
参考答案:A
本题解析:
本题难度:简单
4、选择题 在元素周期表中前四周期的五种元素的位置关系如图示,若B元素的核电荷数为Z,则五种元素的核电荷数之和可能为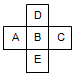
[? ]
A.5Z
B.5Z+18
C.5Z+10
D.5Z+8
参考答案:AC
本题解析:
本题难度:简单
5、选择题 原子序数从3-10的元素,随着核电荷数的递增而逐渐增大的是
A.电子层数
B.电子数
C.原子半径
D.化合价
参考答案:B
本题解析:3-10号元素是同一周期元素,电子层数相同,电子数依次递增,原子半径依次减小.化合价没有明显规律,最高正价递增.
本题难度:一般