时间:2017-08-26 00:19:28
1、填空题 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示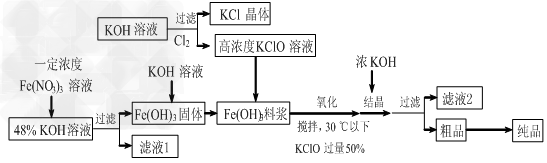
(1)上述氧化过程中,发生反应的离子方程式是:________________,控制反应温度30℃以下的原因是:___________________。
(2)结晶过程中加入浓KOH溶液的作用是:___________________。
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在_____附近、反应时间应控制在________。 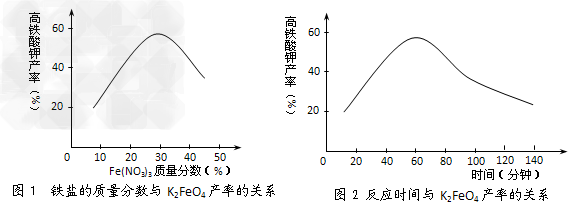
参考答案:(1)2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;防止生成的K2FeO4发生分解
(2)增大K+,促进K2FeO4晶体析出?
(3)30%;60min
本题解析:
本题难度:一般
2、填空题 某同学模拟化工生产设计工业合成硝酸铵的流程图如下。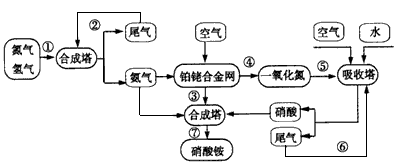
(1)合成氨用的原料氢气一般用水煤气法制得,写出该反应的化学方程式:___。
(2)吸收塔中通入空气的目的是___,用化学方程式表示:___。
(3)在合成氨中,为了有效提高合成氨的产率,实际生产中宜采用的措施主要有:___
(4)上述流程图中,体现绿色化学和环境保护理念的措施主要有___(填序号)。
参考答案:(1) C+H2O(g) CO+H2
CO+H2
(2)使NO尽可能多地转化为硝酸;4NO+2H2O+3O2==4HNO3
(3)适当增大压强,及时分离出氨气,氮气和氢气循环使用等
(4)②③⑥
本题解析:
本题难度:一般
3、填空题 由固体碱熔氧化法可制备重铬酸钾,已知精选后的铬铁矿主要成分是亚铬酸铁[Fe(CrO2)2或
FeO·Cr2O3],还含有硅、铝的氧化物等杂质。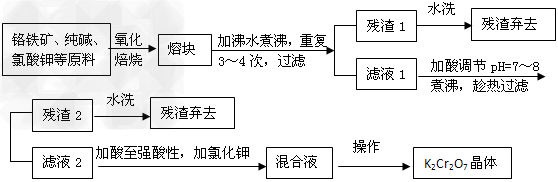
(1)若氧化焙烧在实验室进行,所用的主要仪器是______(填序号,下同);蒸发浓缩时所用的主要仪器是_______。
A.蒸发皿?B.普通坩埚?C.铁坩埚
(2)氧化焙烧时,发生重要反应的化学方程式有: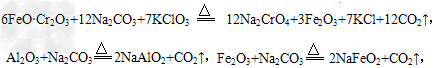 ?
?
以及:__________________。
(3)用水浸取熔块时,NaFeO2强烈水解,生成氢氧化铁沉淀而除去,试写出离子方程式: __________________________________。
(4)残渣2的主要成分有(填化学式)___________、_____________。
(5)已知K2Cr2O7和NaCl两种物质的溶解度随温度变化变化如下 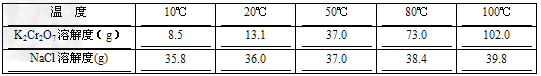
则最后一步由混合液转变成K2Cr2O7晶体的操作是_______、_______、过滤、洗涤、烘干。
参考答案:(1)C;A
(2)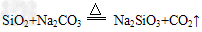
(3)FeO2-+?2H2O?=?Fe(OH)3↓?+?OH-
(4)Al(OH)3;H2SiO3
(5)蒸发浓缩;冷却结晶
本题解析:
本题难度:一般
4、填空题 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含
Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下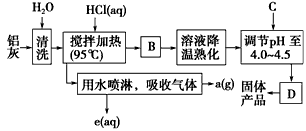
(1)搅拌加热操作过程中发生反应的离子方程式:________________、______________。
(2)生产过程中操作B和D的名称均为________(B和D为简单操作)。
(3)反应中副产品a是________(用化学式表示)。
(4)生产过程中可循环使用的物质是_ _______(用化学式表示)。
(5)调节pH至4.0~4.5的目的是 __________________________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用__________
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
参考答案:(1)Al2O3+6H+==2Al3++3H2O;2Al+6H+==2Al3++3H2↑
(2)过滤
(3)H2
(4)HCl
(5)促进AlCl3水解,使晶体析出
(6)BD
本题解析:
本题难度:一般
5、填空题 工业生产中产生的含SO2废气经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等,以下是工业利用硫酸钙的部分流程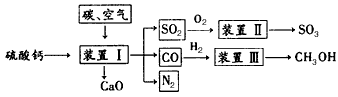
(1)生产中常在装置I里加入SiO2,其主要作用:①生产水泥;②还可________________。
(2)装置Ⅱ中,为了提高SO2的转化率,可采用的措施是:_________
A.加入V2O5作催化剂 B.采用过量SO2 C.低温 D.通入过量空气
(3)装置Ⅲ中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)。 已知:
2CO(g)+O2(g) = 2CO2(g); △H= - 566kJ/mol
2H2O(g) = 2H2(g) +O2(g);△H= +484 kJ/mol
CH3OH(g) +1/2O2(g)=CO2(g) +2H2(g); △H= - 192.9kJ/mol
试写出CO与H2在一定条件下反应生成CH3OH(g)的热化学方程式_________________;若将生成的CH3OH与氢氧化钾溶液、氧气构成燃料电池,则燃料电池的负极反应式为:____________________
(4)已知25℃时,Ksp(CaSO4)=7.10×10-5。在0.100 L 0. 200 mol/L CaCl2溶液中加入2.72 g CaSO4粉末充分 搅拌后,假设溶液的体积变化忽略不计,则溶液中SO42-物质的量浓度为:__________mol/L。
参考答案:(1)降低反应所需温度或降低能耗
(2)D
(3)CO(g)+2H2(g)=CH3OH(g); △H= -90.1 kJ/mol;CH3OH+ 8OH- -6e-= CO32- +6H2O
(4)3.55×10-4
本题解析:
本题难度:一般