时间:2017-08-26 00:19:28
1、填空题 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000°C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是__________,_________反射炉内生成炉渣的主要成分是____;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是____;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极____(填图中的字母);在电极d上发生的电极反应式为______;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____。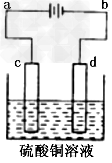
参考答案:(1)2Cu2FeS2+O2 Cu2S+2FeS+?SO2;2FeS+3O2
Cu2S+2FeS+?SO2;2FeS+3O2 2FeO+2SO2;FeSiO3
2FeO+2SO2;FeSiO3
(2)2Cu2S+3O2 2Cu2O+2SO2、2Cu2O+?Cu2S
2Cu2O+2SO2、2Cu2O+?Cu2S 6Cu+?SO2↑
6Cu+?SO2↑
(3)c;Cu2++2e-=Cu;Au、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中
本题解析:
本题难度:一般
2、填空题 【三选一—选修化学与技术】
?二氧化氯(ClO2)被称作第四代杀菌消毒剂。工业上用NaCl?还原NaClO3生产ClO2的工艺流程如图所示:?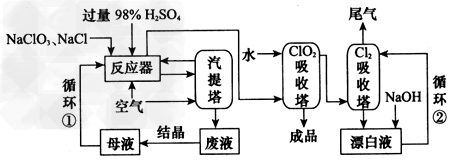
(1)反应器中发生的化学反应方程式为___________?,反应器中生成的ClO2和Cl2?由通入空气驱出进入ClO2吸收塔,产生的混合液进入汽提塔,汽提塔排出废液中溶质的成分主要是________________ ?(填化学式)。 ?
(2)生产中将NaClO3和NaCl按物质的量之比1:1.05的混 ?合水溶液加入反应器。NaCl稍过量的目的是____________。 ?
(3)制取ClO2可用阳离子交换膜分隔的电解池电解NaClO2溶液,在阳极室加入的物质是___________,在阴极室产生的物质是________,电解的离子方程式可表示为______。
参考答案:(1)2NaClO3+2NaCl+2H2SO4=2ClO2↑+ Cl2↑+2Na2SO4+2H2O ;Na2SO4、H2SO4、NaCl
(2)使NaClO3充分反应(或提高NaClO3的利用率)
(3)?NaClO2溶液 ;H2和NaOH ;2ClO2-+2H2O 2ClO2↑+H2↑+2OH-
2ClO2↑+H2↑+2OH-
本题解析:
本题难度:一般
3、选择题 天然气的主要成分是
[? ]
A.一氧化碳和氢气
B.甲烷
C.乙烯
D.乙烷
参考答案:B
本题解析:
本题难度:简单
4、填空题 Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。 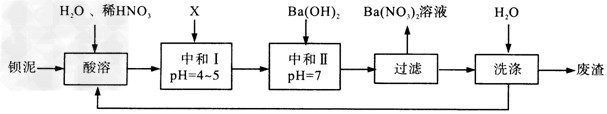
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:______________________________
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:______________________。 ?
(3)该厂结合本厂实际,选用的X为________(填序号);
A.BaCl2? B.BaCO3? C.Ba(NO3)2? D.Ba(OH)2 ?
(4)中和I使溶液的p?H为4~5目的是__________________;结合离子方程式简述原理_______________________。 ?
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是___________________。 ?
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为______________。
参考答案:(1)BaSO4+CO32-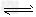 BaCO3+?SO42-
BaCO3+?SO42-
(2)Ba(FeO2)2?+8HNO3?=?Ba(NO3)2+2Fe(NO3)3+4H2O
(3)B?
(4)使Fe3+完全沉淀;Fe3++3H2O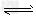 Fe(OH)3+?H+,BaCO3消耗H+使Fe3+水解平衡右移,形成Fe(OH)3沉淀
Fe(OH)3+?H+,BaCO3消耗H+使Fe3+水解平衡右移,形成Fe(OH)3沉淀
(5)蒸发结晶
(6)261m/233w×100%
本题解析:
本题难度:一般
5、填空题 四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下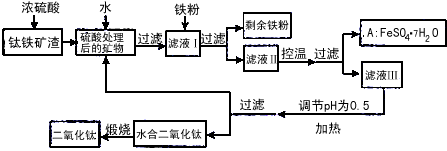
请回答下列问题
(1)硫酸与二氧化钛反应的化学方程式是___________________。
(2)向滤液I中加入铁粉,发生反应的离子方程式为:___________________、___________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:________________________________。过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、_____________、____________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料
______________kg。
参考答案:(1)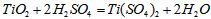 (或
(或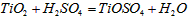 )
)
(2)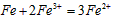 ;
;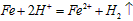
(3)加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解;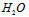 ;
;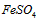 ;
;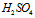
(4)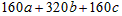
本题解析:
本题难度:困难