时间:2017-08-26 00:19:28
1、填空题 重晶石矿石主要含有BaSO4,还含有少量有SiO2、Al2O3、Fe2O3、MnO2、FeS2、Na2O、K2O等杂质。以下是某工业制备硫酸钡以及分离某些金属的流程图。 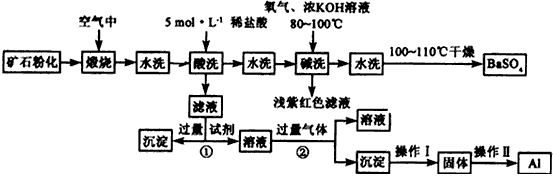
(1)煅烧过程中产生的污染性气体主要是_______________。
(2)确定第一次水洗液中有K+存在的实验现象是_____________。
(3)写出碱洗时的氧化还原反应方程式:_________________。
(4)①反应生成沉淀的化学式__________,②反应的离子方程式为___________________。
(5)操作I为______,操作Ⅱ为_______。
参考答案:(1)SO2
(2)焰色反应中通过蓝色钴玻璃观察火焰呈紫色
(3)4MnO2+3O2+4KOH-=4KMnO4+2H2O
(4)①Fe(OH)3;②AlO2-+CO2+2H2O=Al(OH)3+HCO3-
(5)加热;电解
本题解析:
本题难度:一般
2、选择题 属于铝热反应的是
[? ]
A、Al+HCl?
B、Al+?Fe2O3?
C、Al+NaOH?
D、Al+O2
参考答案:B
本题解析:
本题难度:简单
3、填空题 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
?I.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
V.煅烧FeCO3,得到Fe2O3固体。 已知:NH4HCO3在热水中分解。
(1)I中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是___________________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用___________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是____________________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是__________________________。
(5)已知煅烧FeCO3的化学方程式是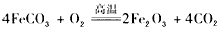 现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中 Fe2O3的质量是______________ kg。(摩尔质量/g/mol:FeCO3 116 Fe2O3 160 FeO 72)
现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中 Fe2O3的质量是______________ kg。(摩尔质量/g/mol:FeCO3 116 Fe2O3 160 FeO 72)
参考答案:(1)Fe +2Fe3+=3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2O Fe(OH)2 +2H+ 的平衡向逆反应方向移动,从而抑制Fe2+的水解
Fe(OH)2 +2H+ 的平衡向逆反应方向移动,从而抑制Fe2+的水解
(3) ;
;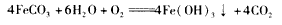
(4)取少量洗涤后的溶液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0
本题解析:
本题难度:一般
4、选择题 某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下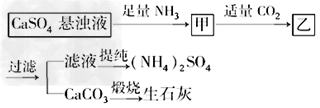
下列推断不合理的是
[? ]
A.往甲中通适量CO2有利于(NH4)2SO4生成
B.生成1?mol(NH4)2SO4至少消耗2?molNH3
C.CO2可被循环利用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
参考答案:D
本题解析:
本题难度:一般
5、填空题 工业上用重晶石(主要成分BaSO4)为原料制备BaCl2和锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程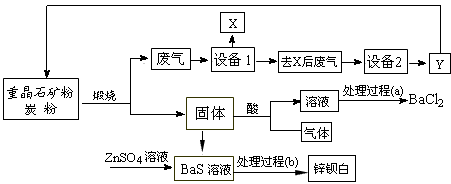
请根据上述流程回答下列问题
(1)假设煅烧时还原产物只有BaS,则反应的化学方程式为___________________________;
(2)设备2中所用的洗涤剂是碱液,则Y的化学式为________________________;
(3)溶解固体所用的酸为____________(写化学式),生成的气体用过量NaOH溶液吸收,其反应的离子方程式为_______________________________;
(4)处理过程(b)的具体步骤为______________________;
(5)锌钡白的成分是___________________(写化学式)。
参考答案:(1)BaSO4+4C 4CO↑+BaS(或BaSO4+2C
4CO↑+BaS(或BaSO4+2C 2CO2↑+BaS)
2CO2↑+BaS)
(2)CO
(3)HCl;2OH-+H2S==S2-+H2O
(4)过滤、洗涤、干燥
(5)BaSO4和ZnS
本题解析:
本题难度:一般