时间:2017-08-22 17:08:22
1、填空题 有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是________________________
参考答案:丙丁乙甲
本题解析:
本题难度:一般
2、选择题 下列叙述不正确的是
A.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑
B.铁船船体上镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+ 2H2O+4e-= 4OH-
D.原电池负极发生的电极反应是还原反应
参考答案:D
本题解析:原电池中,负极失去电子,发生氧化反应,所以选项D是错误的,其余都是正确的,答案选D。
本题难度:简单
3、填空题 (3分)若以铁棒、碳棒、导线和氯化铁溶液为用品设计原电池。电池反应式为_________________________。?
参考答案: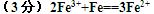
本题解析:略
本题难度:一般
4、选择题 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq) ===2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2,电解过程中,以下判断正确的是
Al2O3+3H2,电解过程中,以下判断正确的是
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 molPb | 生成2 molAl2O3 |
| C | 正极:PbO2+4H++2e-===Pb2++2H2O | 阳极:2Al+3H2O-6e-===Al2O3+6H+ |
| D |  |  |
参考答案:D
本题解析:A、原电池中,溶液中氢离子向正极移动,故不选A;B、串联电池中转移电子数相等,每消耗3摩尔铅,根据电子守恒,生成1摩尔的氧化铝,故不选B;C、原电池正极上二氧化铅得到电子生成硫酸铅,故不选C;D、原电池中铅做负极,负极上铅变成硫酸铅,质量增加,在电解池中,铅为阴极,阴极上氢离子得电子,生成氢气,所以电极质量不变,故选D。
考点:原电池和电解质的原理。
本题难度:一般
5、选择题 在铜一锌一硫酸构成的原电池中,当导线中有1mol电子通时,理论上的两极变化是
①锌片溶解32.5g? ②锌片增重32.5g ③铜片上析出1 gH2 ④铜片上析出1mol H2
A.①③
B.①④
C.②③
D.②④
参考答案:A
本题解析:
分析:锌-铜-稀硫酸组成的原电池装置中,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答:解:该原电池放电时,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电池反应式为
Zn+H2SO4=ZnSO4+H2↑.
设当导线中有1mol电子通过时,理论上负极锌片溶解x,铜片上析出氢气y.
Zn+H2SO4=ZnSO4+H2↑?转移电子
65g? 2g? 2mol
x? y? 1mol
x=32.5g?
y=1g
故选A.
点评:本题以原电池原理为载体考查了物质的量的有关计算,难度不大,根据电池反应式计算即可.
本题难度:一般