时间:2017-08-22 17:08:22
1、选择题 有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是(?)?
A.D >C >A >B?B. D >A >B >C
C.D >B >A >C?D.B >A >D >C
参考答案:B
本题解析:原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属,据此可以解答。两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B;金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜。如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C,所以金属的活动性顺序为:D>A>B>C,故选B。
点评:该题是高考中的常见题型,属于中等难度的试题。有利于培养学生的逻辑推理能力和发散思维能力。答题时能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属最高价氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱,注意相关知识的积累和总结。
本题难度:简单
2、选择题 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
A.Zn是负极
B.电流由Zn经外电路流向Cu
C.Zn电极上发生还原反应
D.Cu电极反应:Cu2++2e-═Cu
参考答案:A、Zn、Cu、硫酸构成的原电池中,活泼金属锌做负极,金属铜做正极,故A正确;
B、原电池中电流从正极流向负极,即从铜片经导线流向锌片,故B错误;
C、原电池的负极反应是负极金属失电子的氧化反应,故C错误;
D、原电池的正极反应是:2H++2e-→H2↑,故D错误;
故选A.
本题解析:
本题难度:简单
3、填空题 (5分)下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式是_______________________________________。
(2)B中Cu极的电极反应式是______________________________________。
(3)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是_____________(用“>”表示)。
参考答案: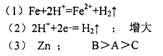
本题解析:略
本题难度:简单
4、选择题 下图是锌-铜-稀硫酸原电池装置,下列叙述正确的的是
A.锌是正极,铜是负极,电流的方向是从锌到铜
B.锌片质量减少,铜片质量增加
C.正极和负极上发生的都是氧化还原反应
D.原电池中的能量变化是:化学能转化为电能
参考答案:D
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌的金属性强于铜的,所以锌是负极,失去电子。铜是正极,溶液中的氢离子再正极得到电子,生成氢气而析出。A、B、C都不正确,D正确,答案选D。
点评:该题是中等难度的试题,试题基础性强,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确原电池工作原理,然后结合题意灵活运用即可,有利于提高学生的应试能力,提升学生的学科素养。
本题难度:一般
5、选择题 下列溶液中微粒的物质的量浓度关系正确的是:
A.室温下,向0.01mol·L-NH4HSO4溶液中滴加NaOH 溶液至中性:
c(Na+)>c((SO42-)>c(NH4+)>c(OH-)=c(H+)
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c((HCO3-)>c(H+)
C.Na2CO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3)
D.25℃时,,pH=4.75、浓度均为0.1mol·L-1的CH3COOH 、CH3COONa 混合溶液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
参考答案:AC
本题解析:由于HCO3-的水解毕竟是微弱的,所以c(OH-)不可能大于c((HCO3-),所以B错误;
D中的关系应是:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+),所以D错误;
正确答案为A、C。
本题难度:一般