时间:2017-08-22 17:08:00
1、填空题 (5分)在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体、B为金属单质,D、E、M是常见气体单质,其中M为黄绿色,N是胃酸主要成分,工业上用E和M来制取N,试推断: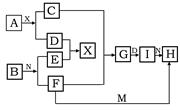
(1)写出下列化学式? A??I?
(2)G转化为I的现象为?
(3)F+M→H离子方程式为?
(4)A+X→C+D的化学方程式为________________________
参考答案:(1)Na2O2、Fe(OH)3。(2)白色沉淀迅速转化为灰绿色,最后转化为红褐色。
(3)2Fe2++Cl2=2Fe3+?(4)2Na2O2+2H2O=4NaOH+O2↑
本题解析:M为黄绿色,则M是氯气,N是胃酸主要成分,则N是氯化氢。A为淡黄色固体,因此A是过氧化钠。B为金属单质,则E是氢气,F和氯气可以继续反应,说明B是变价金属,即为铁,所以F是氯化亚铁。H是氯化铁。D和氢气反应,所以D是氧气。X是水,C是氢氧化钠,G是氢氧化亚铁,I是氢氧化铁。
本题难度:一般
2、选择题 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊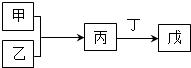
参考答案:B
本题解析:
本题难度:简单
3、推断题 物质A~H是我们熟悉的单质或化合物,其中A、F为金属单质,A在空气中燃烧火焰为黄色,F合金的用量是金属中最大的。C、D为气态非金属单质,D呈黄绿色。G的水溶液呈浅绿色,在适当的条件下它们之间可以发生如下图所示的转化(部分产物被略去)。 
试回答下列问题:
⑴E的化学式为____________;
⑵A在空气中燃烧的化学方程式是________________________;
⑶A与水反应的的离子方程式是________________________;
⑷写出G溶液中滴加B溶液后观察到的现象____________。
参考答案:⑴HCl
⑵2Na+O2 Na2O2?
Na2O2?
⑶2Na+2H2O=2Na++2OH-+H2↑
⑷先生成白色沉淀,很快变成灰绿色,最终变成红褐色
本题解析:
本题难度:一般
4、填空题 在下列各变化中,E为无色无味的液体(常温 下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:
(1) 写出反应②的化学反应方程式?,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是?。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间。则反应①的化学方程式是?。
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种无色的气体,且B遇盐酸产生无色无味的气体。在加热条件下,当A过量时,反应①的离子方程式是?。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水。则A过量时反应①的离子反应方程式是?。
参考答案:(1)2Na2O2+2H2O=4NaOH+O2↑?(2分)? 0.2mol(2分)
(2)Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(3)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O(2分)
NH3↑+CO32-+2H2O(2分)
(4)AlO2-+4H+=Al3++2H2O(2分)
本题解析:E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.
(1)设该反应转移电子的物质的量xmol
Na2O2+2H2O="4NaOH" + O2↑?转移电子数
22.4L? 2mol?
2.24L? x?x=0.2mol,
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,A是氯气,与碱反应,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O
(3)B是一种酸式盐,且B遇盐酸有无色无味气体产生,所以B是碳酸氢盐, D是一种气体,强碱与酸式盐反应生成气体,该气体是氨气,所以A、B的反应是强碱和碳酸氢铵的反应,故答案为:2OH-+NH4++HCO3-=NH3↑+2H2O+CO32-
(4)B是一种含有两种金属元素的盐,所以B是偏铝酸钠,A是一种强酸,酸先和偏氯酸钠反应生成氢氧化铝,氢氧化铝和过量的酸反应生成铝离子,故答案为:AlO2-+4H+=Al3++2H2O.
本题难度:一般
5、填空题 (13分)甲、乙、丙为短周期常见的单质,乙、丙两元素的原子序数相差8。X、A、B、C、D、E、F、G均为常见的化合物,其中A、G的焰色反应为黄色,A和X的摩尔质量相同。在一定条件下,各物质相互转化关系如下图。
请回答:
(1) 写化学式:X?,C?D?。
(2)写出反应④、⑤的化学反应方程式:④?;
⑤?
(3)写出反应⑧、⑨的离子方程式⑧?
⑨?。
(4)在上图的反应中,不属于氧化还原反应的是(填序号)?。
参考答案:(共13分)(1) Na2S?(1分) Na2SO4(1分) SO2(1分)
(2) ④2Na2O2 + 2H2O ??4NaOH + O2↑(2分)
⑤2Na2O2 + 2CO2??2Na2CO3 + O2(2分)
(3)⑧ SO3+2OH-??SO42-+ H2O?(2分)
⑨ HCO3- + OH-??CO32- + H2O (2分)
(4) ⑧⑨(2分)
本题解析:甲、乙均可和丙反应,条件为点燃,可知丙为O2;与O原子序数相差8的乙元素必为S;
甲燃烧生成的A为氧化物,再与CO2反应生成O2,可推知A为Na2O2,甲为钠;
Na2O2与SO2可发生氧化还原反应生成Na2SO4。
本题难度:一般