时间:2017-08-22 17:08:00
1、填空题 已知有以下物质相互转化
焰色反应显紫色,说明D溶液中含有K元素。又因为D能和硝酸银溶液反应生成白色沉淀氯化银,所以D应该是氯化钾。EF的转化以及沉淀颜色可知,E是氢氧化亚铁、F是氢氧化铁,G则氯化铁。B和C反应生成氯化钾和氢氧化亚铁,所以BC是氢氧化钾和氯化亚铁。G能和A反应生成B,所以A是铁,B是氯化亚铁,C是氢氧化钾,气体是氢气。
试回答:试回答:(1)写出E的化学式?,H的化学式?。
(2)写出由E转变成F的化学方程式?。
(3)检验G溶液中的金属阳离子的方法是:?;
向G溶液加入A的有关离子反应方程式?。
(4)写出A在一定条件下与水反应的化学方程式?。
参考答案:(1)Fe(OH)2? AgCl(各1分)(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(3)取少量G溶液于试管中,向试管中滴加少量KSCN溶液,若出现红色,则证明溶液中有Fe3+ (2分)? 2Fe3++Fe=3Fe2+ (2分)(4) ?(各2分)
?(各2分)
本题解析:焰色反应显紫色,说明D溶液中含有K元素。又因为D能和硝酸银溶液反应生成白色沉淀氯化银,所以D应该是氯化钾。EF的转化以及沉淀颜色可知,E是氢氧化亚铁、F是氢氧化铁,G则氯化铁。B和C反应生成氯化钾和氢氧化亚铁,所以BC是氢氧化钾和氯化亚铁。G能和A反应生成B,所以A是铁,B是氯化亚铁,C是氢氧化钾,气体是氢气。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、推断题 相对分子质量为248的A·5H2O是无色透明晶体,无臭,味咸,在纺织工业中用于棉织品漂白后的脱氯剂等用途。甲是淡黄色固体、不溶于水,易溶于二硫化碳;乙、丙是气体,反应①可以制取三种重要的化工原料,乙可与E反应;D ?是形成酸雨的污染物,F是过量的E与D反应后的物质。如图是关于A及相关物质性质与制备A的相互转化关系。?
(1)写出E的电子式:________,组成乙的元素原子结构示意图是________,反应②的条件是___________。 ?
(2)写出反应①电解的阴极电极反应式:_____________ 。?
(3)写出A与B溶液反应的离子方程式:_______________。 ?
(4)写出甲与F溶液反应制备A的化学方程式:_______________。
参考答案:(1)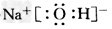 ?;
?; ;? 点燃
;? 点燃
(2)2H2O+2e-=H2↑+2OH-?
(3)S2O32-+2H+=S↓+SO2↑+H2O
(4)Na2SO3+S=Na2S2O3
本题解析:
本题难度:一般
3、填空题 (10分)下图中的每一个方格表示有关的一种反应物或生成物,其中A,C,D为无色气体.请填下列空白: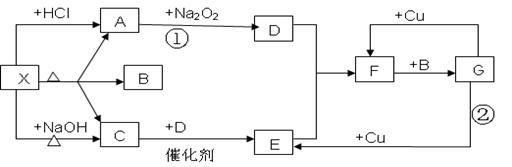
(1)物质X可以是______________________,C 是____________,F是____________.
(2)反应①化学方程式是________________________________________________。
(3)反应②的离子方程式是______________________________________________。
参考答案:(10分)
(1)? (NH4)2CO3?或NH4HCO3,?NH3 ,? NO2
(2 )? 2CO2+2Na2O2=2Na2CO3+O2
(3 )? 2NO3- + 8 H+ + 3Cu==2NO+3Cu2++4H2O
H+ + 3Cu==2NO+3Cu2++4H2O
本题解析:略
本题难度:一般
4、推断题 下图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去)。 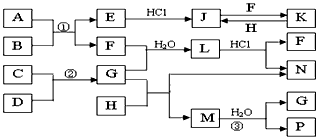
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式__________;G的水溶液中,最多的阳离子是__________。
(2)写出K与H反应的离子方程式:____________________;G与H反应的化学方程式:____________________。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释______________________________
参考答案:(1)SO2;NH4+
(2)2Fe2++Cl2==2Fe3++2Cl-;4NH3+3Cl2==NCl3+3NH4Cl
(3)饱和H水溶液中存在平衡:Cl2+H2O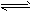 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
本题解析:
本题难度:一般
5、简答题 甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.
已知:甲、乙晶体类型相同,单质甲能与乙发生置换反应,丙、丁、戊三种粒子均含有等量的总电子数,其中丙、戊是同一类晶体中的分子,戊在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合“等电子原理”(具有相同电子数和原子数的分子或离子互称为等电子体).
(1)写出液态戊产生两种等电子粒子的电离方程式:______.
(2)写出甲与乙发生置换反应的反应方程式:______.
(3)丙是目前重要的能源之一.
①丙和戊在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是:______.
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其负极反应的电极方程式为______.
(4)含丁的硝酸盐溶液显酸性,原因是(用离子方程式表示):______.
参考答案:丙、丁、戊三种粒子均含有等量的总电子数,其中丙、戊是同一类晶体中的分子,戊在常温下呈液态,能产生两种10电子的离子,推断戊为H2O,电离生成水合氢离子和氢氧根离子;与水电子数相同的正四面体的分子,丙为10电子微粒推断为CH4,丁是阳离子且与丙符合“等电子原理”,为10电子阳离子,所以丁为NH4+;甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,都是正四面体结构,甲、乙晶体类型相同,单质甲能与乙发生置换反应,单质为四面体和化合物为四面体的物质发生置换反应,推断甲为C,乙为SiO2;
(1)液态戊为H2O产生两种等电子粒子的电离方程式为2H2O?H3O++OH-,故答案为:2H2O?H3O++OH-;?
(2)甲与乙是C和SiO2发生置换反应的反应方程式为SiO2+2C?高温?.?Si+2CO↑,故答案为:SiO2+2C?高温?.?Si+2CO↑;
(3)①丙为CH4和戊为H2O在催化、加热条件下得到可燃性的两种气体,判断为氢气和一氧化碳,其反应的化学方程式是:CH4+H2O催化剂
本题解析:
本题难度:一般