时间:2017-08-22 16:21:02
1、填空题 (1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。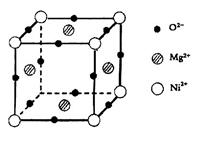
参考答案:(1)3d7(1分)?(2)三角锥形(1分)?(3)sp(1分)
(4)共价键、范德华力(或分子间作用力)(2分)?
(5)8(2分)、Mg2NiO3(1分)
本题解析:(1)Co原子序数为27,Co2+失去了2个电子,价电子排布式为3d7
(2)根据价电子互斥理论可推出SO32-的空间构型是三角锥形。
(3)等电子体结构相似,所以OCN-中C原子的杂化方式与CO2相同。
(4)N、B之间形成共价键,六方氮化硼(BN)晶体为层状结构,层与层之间作用力为范德华力。
(5)根据晶胞的结构,结合立体几何知识可看出每个Ni2+离子与8个Mg2+离子配位;该晶胞含O2?:12×1/4="3," Mg2+: 4×1/2="2" , Ni2+: 8×1/8=1,可得出化学式。
本题难度:一般
2、选择题 下列有关化学用语的使用正确的是高
[? ]
A.中子数为6的碳原子 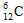
B.MgCl2的电子式 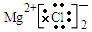
C.硫离子结构示意图 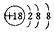
D.CH4S的结构式 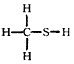
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列物质中,既有共价键又有分子间作用力的是?(?)
A.氦
B.氨
C.铜
D.二氧化硅
参考答案:B
本题解析:氦气是单原子分子,无共价键;铜为金属晶体,只存在金属键;二氧化硅为原子晶体,只存在共价键,而氨为分子晶体,分子间为分子间作用力,而分子内为共价键,符合题意。
本题难度:一般
4、选择题 下列化学式能真实表示物质分子组成的是(?)
A.NaOH
B.SO3
C.CsCl
D.SiO2
参考答案:B
本题解析:能用化学式表示物质分子组成的必须是分子晶体,由分子组成,NaOH是离子晶体,有阴、阳离子构成; SO3是分子晶体,由分子组成;CsCl是离子晶体; SiO2是原子晶体,是由原子组成的。
点评:本题考查晶体类型的判断,题目难度不大,注意只有分子晶体才含有单个分子,化学式即分子式。
本题难度:简单
5、填空题 【化学—物质结构与性质】氯是一种非常重要的非金属元素。
(1)氯元素的基态原子的价电子层排布式是?。
(2)氯化氢的沸点远低于氟化氢,液态氟化氢的化学式有时写成(HF)n,其原因是:?.
(3)光气(COCl2)中C原子采取?杂化成键,其碳氧原子间的共价键含有?(填“σ”或“π”键及个数)。
(4)元素Cu的一种氯化物的晶胞结构如图所示(黑球表示铜原子,白球表示氯原子),该氯化物的分子式?,它可与浓氨水反应生成无色溶液,在空气中放置一段时间,最终溶液变成深蓝色,则深蓝色溶液中生成配合物为?(填化学式)。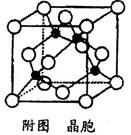
参考答案:(8分)【化学—物质结构与性质】
(1)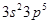
(2)HF分子之间存在氢键作用,故沸点明显高于氯化氢
(3)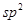 ;1个σ键,1个π键
;1个σ键,1个π键
(4)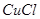 ?;
?;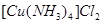
本题解析:(1)由构造原理可知氯元素的基态原子的价电子层排布式是: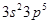 ;
;
(2)氯化氢的沸点远低于氟化氢,液态氟化氢的化学式有时写成(HF)n,其原因是;HF分子之间存在氢键作用,故沸点明显高于氯化氢;
(3)光气(COCl2)中C原子采取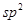 ;其碳氧原子间的共价键含有1个σ键,1个π键;
;其碳氧原子间的共价键含有1个σ键,1个π键;
(4)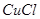 ?;
?;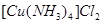
本题难度:一般