时间:2017-08-22 16:21:02
1、选择题 下列不能形成配位键的组合是( )
A.Ag+、NH3
B.BF3、NH3
C.Co3+、CO
D.Ag+、H+
参考答案:D
本题解析:配位键形成的前提是成键双方分别提供空轨道和孤对电子,而Ag+、H+均无法提供孤对电子,不能形成配位键。
本题难度:简单
2、选择题 下列分子为直线形分子且分子中原子都满足8电子稳定结构的是
A.BeF2
B.C2H2
C.SO2
D.CO2
参考答案:D
本题解析:只要化合物中元素化合价的绝对值和该元素原子的最外层电子数之和满足8,则该元素原子就能满足8电子稳定结构,据此可知,选项D正确,A中Be、B中的氢元素、C中的S元素均不能满足8电子稳定结构,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础性强,侧重对学生基础知识的巩固和训练。该题的关键是明确8电子稳定结构的判断依据,然后灵活运用即可。
本题难度:简单
3、选择题
16.下列分子中,键能最小的是?(?)
A.F2
B.Br2
C.Cl2
D.N2
参考答案:
答案:A
本题解析:
N2中含有一个三键,键能较大;F2、Br2、Cl2中只有一个单键,键能小,F2分子中电子“密度”大,F原子间斥力大,键能最小
本题难度:一般
4、选择题 下列化学用语正确的是
[? ]
A.氯化钠的电子式: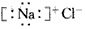
B.乙烯的分子式:C2H4
C.磷原子的结构示意图: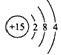
D.乙酸的结构简式:C2H4O2
参考答案:B
本题解析:
本题难度:简单
5、填空题 原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V型分子,c的+1价离子比e的﹣1价离子少8个电子.
回答下列问题:
(1)元素a为 ,c为 ? ;
(2)由这些元素形成的双原子分子为 ? ;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线型的是 ? ,非直线型的是 ? (写两种);
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是 ? ,离子晶体的是 ? ,金属晶体的是 ? ,分子晶体的是 ? ;(每空填一种)
(5)元素a和b形成的一种化合物与c和d形成的一种化合物发生的反应常用于防毒面具,该反应的化学方程式为 ? .
参考答案:(1)C、Na(2)CO(3)CO2;H2O、H2S(4)金刚石;氯化钠;钠;硫或一氧化碳(5)2Na2O2+2CO2=2Na2CO3+O2
本题解析:原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍,所以a是C元素;b和d的A2B型氢化物均为V型分子,且b的原子序数小于d的原子序数,所以b是O元素,d是S元素;c的+1价离子比e的﹣1价离子少8个电子,且都是短周期元素,所以c是Na元素,e是Cl元素.
解:原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍,所以a是C元素;b和d的A2B型氢化物均为V型分子,且b的原子序数小于d的原子序数,所以b是O元素,d是S元素;c的+1价离子比e的﹣1价离子少8个电子,且都是短周期元素,所以c是Na元素,e是Cl元素.
(1)a是C;C是Na.
故答案为:C、Na.
(2)由这些元素形成的双原子分子为CO.
故答案为:CO.
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是CO2,非直线形的是:H2O H2S.
故答案为:CO2;H2O、H2S.
(4)这些元素的单质或由他们形成的AB型化合物中,其晶体类型属于原子晶体的是金刚石,离子晶体的是NaCl,金属晶体的是Na,分子晶体的是 S 或CO.
故答案为:金刚石;氯化钠;钠;硫或一氧化碳.
(5)元素a和b形成的一种化合物是一氧化碳,与c和b形成的一种化合物是过氧化钠,二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2.故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评:本题以元素 推断为载体考查了物质的结构和性质,能正确推断元素是解本题的关键,难度不大.
本题难度:一般