时间:2017-08-22 16:13:44
1、推断题 A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题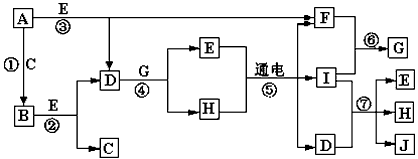
(1)B中的化学键有________(填“离子键”、“极性键”或“非极性键”) E的电子式________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)常温下1克F单质在足量C单质中燃烧生成稳定的液态物质E释放出142.9kJ热量,写出液态E分解的热化学方程式________________。
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在________(填“阴或阳”)极附近溶液由无色变为红色,其原因是________________。
参考答案:(1)离子键、非极性键;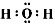 ?
?
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3)4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑
(4)H2O(l) = H2(g) +1/2O2(g) △H=+285.8kJ/mol
(5)阴极;在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中
c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色
本题解析:
本题难度:一般
2、简答题 有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去.
(1)若A与NaOH反应,既可只生成B,又可只生成C,还可生成B+C.
①写出符合上述反应关系的A的化学式______.
②写出上述有关有关反应的离子方程式:生成B的离子方程式为______;生成C的离子方程式为______.
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是______(只写一种),R在A、B、C中的化合价必须满足的条件是______,该反应的离子方程式为______.
参考答案:(1)若A与NaOH反应,既可只生成B,又可只生成C,还可生成B+C,可以推断,
①A的化学式为:CO2;
②生成B的离子方程式为:CO2+2OH-=CO32-+H2O;生成C的离子方程式为:CO2+OH-=HCO3-
故答案为:CO2;CO2+2OH-=CO32-+H2O;CO2+OH-=HCO3-
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A为Cl2,R在A中的化合价处于B、C中化合价之间,离子方程式为为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2;R在A中的化合价处于B、C中化合价之间;Cl2+2OH-=Cl-+ClO-+H2O
本题解析:
本题难度:一般
3、简答题 I:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们.根据以上信息回答下列有关问题:
(1)B2A4、C2A4、E2A4三种化合物的沸点由高到低的顺序为______.
(2)由以上元素中若干种组成化合物中,有许多离子化合物,其中由四种元素组成的摩尔质量最小的一种的化学式是______.
(3)由以上元素中若干种组成化合物中,许多可作为炸药,其中属于铵盐的一种的化学式是______;最新合成的化学式为B1C4D8的物质中同种原子的化学环境完全相同,t它是一种威力极强的炸药,推测它的结构简式是______.
II:由短周期元素组成的以下各单质和化合物之间存在图示转化关系.
(4)若A和甲均不溶于盐酸,则甲与NaOH溶液反应时每1mol甲失去 4mol?e-,写出乙转化为丁的离子方程式______
(5)若A和甲均可溶于盐酸,且A的某种氯化物蒸气密度约为相同条件下单质B(双原子分子)密度的8.34倍,则该氯化物的化学式为______,工业生产单质A的化学方程式为______.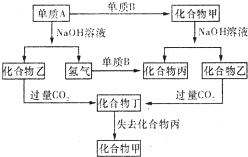
参考答案:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们,则B、A为C元素或H元素,a+b=c,c=1+6=7,即C为N元素;c=7,a+c=d,c+d=e,则a+14=e,若a=1,则e=15,所以A为氢元素,E为磷元素,符合题意;若=6,则e=20,E为钾元素,不是短周期元素,不符合题意.a+c=d,则d=1+7=8,则D为氧元素.
所以A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为磷元素.
(1)B2A4、C2A4、E2A4三种化合物分别为C2H4、N2H4、P2H4,都为分子晶体,相对分子质量越大,沸点越高,但由于氮元素电负性很强,所以N2H4中存在氢键,沸点相对更高,所以沸点由高到低的顺序为N2H4>P2H4>C2H4.
故答案为:N2H4>P2H4>C2H4.
(2)由以上元素中若干种组成化合物中,有许多离子化合物,离子化合物为铵盐,其中由四种元素组成的摩尔质量最小的一种的化学式是 HCOONH4.
故答案为:HCOONH4.
(3)由以上元素中若干种组成化合物中,许多可作为炸药,其中属于铵盐的一种的化学式是NH4NO3;最新合成的化学式为B1C4Ds的物质化学式应是CN4O8,CN4O8中同种原子的化学环境完全相同,它是一种威力极强的炸药,其结构为正四面体,C原子位于正四面体中心,四个顶点均连接1个-NO2,它的结构简式是
.
故答案为:NH4NO3;
.
(4)若A和甲均不溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为硅单质,乙为硅酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为二氧化硅,单质B为氧气.则A与NaOH溶液反应时每1molA失去4 mol?e-,二氧化碳过量生成碳酸氢根,所以乙转化为丁的离子方程式为SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
故答案为:4;SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
(5)若A和甲均可溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为铝单质,乙为偏铝酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为氧化铝,单质B为氧气.A的某种氯化物蒸气密度约为相同条件下单质B(双原子分子)密度的8.34倍,则A的氯化物的相对分子质量为32×8.34=267,则该氯化物的化学式为Al2Cl6,工业生产单质Al为电解熔融的氧化铝,化学方程式为 2Al2O3?冰晶石?.电解4Al+3O2↑.
故答案为:Al2Cl6;2Al2O3?冰晶石?.电解4Al+3O2↑.
本题解析:
本题难度:一般
4、填空题 (14分)A、B、C、D都是中学化学常见物质或离子,其中A、B、C均含有同一种元素,在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去,其他产物都已列出)。请按要求回答下列问题: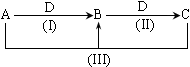
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为_____________________。(4)若D是酸,则一定是多元酸,所以ABCD 分别是
(2)若A常用作致冷剂,B和D为空气的主要成分,则反应(III)的化学方程式为__________。
(3)若D为氯碱工业的重要产品,反应(III)的离子方程式为____________________________。
(4)若D为酸或酸性气体,也能实现上面的转化,请按A、B、C、D顺序写出合理的任意一组物质的化学式。
①当D为酸时,A________、B_________、C_________、D__________。
②当D为酸性气体时,A________、B_________、C_________、D__________。
参考答案:(1)FeCl3(2分)? (2)4NH3+6NO 5N2+6H2O(2分)
5N2+6H2O(2分)
(3)Al3++3AlO2-+6H2O==4Al(OH)3↓(2分)
(4)①Ba(OH)2、Ba3(PO4)2、BaHPO4或Ba(H2PO4)2、H3PO4(4分)
②NaOH、Na2CO3、NaHCO3、CO2(其他合理答案给分)(4分)
本题解析:(1)用量最大、用途最广的金属是铁,即D是铁。铁具有还原性且属于变价金属,A、B、C均含有同一种元素,加热蒸干B的溶液没有得到B的盐,说明该盐是盐酸盐,即A、B、C含有的同一种元素是氯元素。则ABC分别是氯气、氯化铁和氯化亚铁。
(2)B和D为空气的主要成分,则二者为氧气和氮气,A常用作致冷剂,是氨气,氨气氧化生成N2,N2氧化生成NO。
(3)D为氯碱工业的重要产品,D是氢氧化钠。ABC属于铝的化合物之间的转化,即A是铝盐,B是氢氧化铝,C是偏铝酸盐。
(4)若D是酸,则一定是多元酸,所以ABCD 分别是Ba(OH)2、Ba3(PO4)2、BaHPO4或Ba(H2PO4)2、H3PO4;若D为酸性气体时,也应该是多元酸对应的酸酐,例如二氧化碳、硫化氢、二氧化硫等。
本题难度:一般
5、填空题 ((2)题每空3分,其余每空2分,共12分)A、B、C、D均为中学化学常见的物质,它们之间的反应关系如下图:
回答下列问题:
(1)若A是可溶性的强碱,B是酸式盐,D不溶于稀硝酸,则B的化学式为________________,有关的离子方程式为___________________________________?。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①若C为能使澄清石灰水变浑浊的无色无味气体 ,该反应的离子方程式为
____________________________________________________?。?
②若A是一种淡黄色固体,且A与B以物质的量之比3∶1混合时,推知B的化学式为
_________?_。
(3)若B为Ca(HCO3)2溶液,A与B的溶液反应时只生成气体C、CaCO3和水,则A的化学式为__________________??。
参考答案:((2)题每空3分,其余每空2分,共12分)
(1)NH4HSO4(2分) NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3↑+2H2O+BaSO4↓(3分)
(2)① 3CO32- + 2Al3+ + 6H2O = 3CO2↑+ 2Al(OH)3↓
或 3HCO3-+ Al3+ ="=" 3CO2↑+ Al(OH)3↓ (3分)② Al2(SO4)3(2分);(3)CaC2(2分)
本题解析:(1)D不溶于稀硝酸,则D时硫酸钡或氯化银。A是可溶性的强碱,B是酸式盐,且反应中生成气体,则气体一定氨气,即A是氢氧化钡,B是硫酸氢铵,方程式为NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3↑+2H2O+BaSO4↓。
(2)D既可溶于盐酸又可溶于NaOH溶液,则D是氢氧化铝。
①C为能使澄清石灰水变浑浊的无色无味气体,则C是CO2,所以方程式为3CO32- + 2Al3+ + 6H2O = 3CO2↑+ 2Al(OH)3↓,或 3HCO3-+ Al3+ ="=" 3CO2↑+ Al(OH)3↓。
②A是一种淡黄色固体,则A是过氧化钠。A与B以物质的量之比3∶1混合,说明B中含有2个铝离子,所以B是硫酸铝。
(3)由于反应中生成碳酸钙沉淀,所以产生的气体应该是A和水反应生成的,所以根据原子守恒可知,A是CaC2。CaC2溶于水生成乙炔和氢氧化钙,氢氧化钙和碳酸氢钙反应生成碳酸钙和水。
本题难度:一般