时间:2017-08-22 16:13:44
1、推断题 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。 
请填空:
(1)形成单质A的原子的结构示意图为_______________,它的最高化合价为____________。
(2)B的化学式(分子式)为 ______________ ,B的晶体类型为________________ 。 B和碳反应生成A和E的化学方程式是_________________。
(3)C的化学式(分子式)为 _________,D的化学式(分子式)为 _______________。
参考答案:(1) ;+4
;+4
(2)SiO2 ;原子晶体 ;SiO2+2C Si+2CO
Si+2CO
(3)CaSiO3 ;Na2SiO3
本题解析:
本题难度:一般
2、简答题 A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B.用圆底烧瓶收集干燥的B,按图1装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;实验室也可用A与浓H2SO4反应制无色气体C,C气体能使品红溶液褪色.用圆底烧瓶收集干燥的C,仍按图1装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
(1)A晶体的化学式是______,B气体的化学式______
(2)图2是制取并收集气体B的部分装置,在图中方框内绘出用圆底烧瓶收集B的仪器装置简图,图中倒置漏斗的作用______
(3)若用一支试管来收集B,检验B气体是否收集满的方法及现象是______.
参考答案:(1)A与NaOH反应生成气体,该气体能使石蕊试液变蓝,说明该气体为NH3,则A应为铵盐,C气体能使品红褪色,应为SO2,则A应为亚硫酸氢盐或亚硫酸盐,所以A为(NH4)2SO3或NH4HSO3,
故答案为:(NH4)2SO3或NH4HSO3;NH3;
(2)氨气极易溶于水,且密度比空气小,应用向下排空气法收集,可用
装置收集,为防止倒吸,应用倒置漏斗贴近液面进行尾气吸收,故答案为:
;防倒吸;
(3)氨气水溶液呈碱性,能使湿润的红色石蕊试纸变蓝,则验满方法可为将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明已收集满,
故答案为:将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明已收集满.
本题解析:
本题难度:一般
3、简答题 如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.
(1)写出下列物质的化学式:A______;F______.
(2)请完成下列化学方程式:
反应①______;
反应④______;
C+D→E的反应______.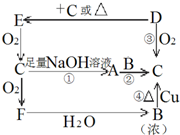
参考答案:E是固态单质,常见于火山口处,则E为硫单质,硫与氧气反应生成C,C与氧气反应生成F,则C为SO2、F为SO3.SO2与足量的NaOH溶液反应生成A为Na2SO3,SO3与水反应生成B为H2SO4.浓硫酸与Na2SO3、Cu都能反应生成C(SO2).D与氧气反应生成SO2,与SO2反应或加热条件下都能生成硫单质,则D为H2S,
(1)由上述分析可知,A为Na2SO3,F为,
故答案为:Na2SO3;SO3;
(2)反应①的方程式为:SO2+2NaOH═Na2SO3+H2O;
反应④的方程式为:Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O;
C+D→E的反应方程式为:SO2+2H2S═3S↓+2H2O,
故答案为:SO2+2NaOH═Na2SO3+H2O;Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O;SO2+2H2S═3S↓+2H2O.
本题解析:
本题难度:简单
4、填空题 (本题16分)硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢。(皓矾为ZnSO4?7H2O)
(1)上述流程中共有7个化学反应,其中有____________个属于氧化还原反应。
(2)写出过氧化氢和物质C的电子式:____________________,_______________。
(3)写出F、G的化学式: F_____________、G_________________。
(4)写出下列化学反应方程式:
反应③__________________________________________________________。
反应⑦____________________________________________________。
(5)取锌钡白固体16.5g溶于100mL 1mol/L的H2SO4溶液中, 放出H2S 气体1008mL(已折算成标准状况)
放出H2S 气体1008mL(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为________mol/L
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,应加入 1 mol/L的NaOH溶液_____mL
参考答案:(本题16分)(1)3 (2分)
(2)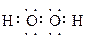 ?
?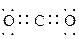 ?(各2分共4分)
?(各2分共4分)
(3)BaCO3? BaO(各1分共2分)
(4)? BaS + ZnSO4 ="=" BaSO4 ↓+ ZnS↓(2分)
BaO2 ?+? H2SO4? ="=?" Ba SO4? +? H2O2(2分)(Ba SO4用了“↓”可不扣分
(5)?①0.05 mol / L?(2分)?② 200 mL(2分)
本题解析:略
本题难度:一般
5、简答题 现有A、B、C、D、E、F、G、H、M几种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,C为气体,E、G为气体单质,F的水溶液与澄清石灰水混合可制得D的溶液.它们之间相互转化的关系如下图,其他与题无关的生成物均已略去.
请回答下列问题:
(1)写出化学式:H______,C______.
(2)A+B反应的化学方程式______
(3)写出D+G→H的离子方程式______.
参考答案:现有A、B、C、D、E、F、G、H、M几种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,则A为Na2O2,A能与C反应得到E与F,且C为气体,E为气体单质,可推知C为CO2,F为Na2CO3,F的水溶液与澄清石灰水混合可制得D的溶液,则D为NaOH,而A与B反应得到D,故B为H2O,G为气体单质,能与氢氧化钠溶液反应得到H,H与二氧化碳、水反应得到M,M光照可以生成氧气,可推知G为Cl2,H为NaClO,M为HClO,
(1)由上述分析可知,H为NaClO,C为CO2,故答案为:NaClO;CO2;
(2)A+B反应的化学方程式为:2Na2O2+2H20=4NaOH+O2↑,故答案为:2Na2O2+2H20=4NaOH+O2↑;
(3)D+G→H的离子方程式为:C12+2OH-=Cl-+ClO-+H2O,故答案为:C12+2OH-=Cl-+ClO-+H2O.
本题解析:
本题难度:一般