时间:2017-08-22 16:09:57
1、填空题 (18分)(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中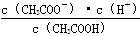 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多
B.H2A多
C.一样多
D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
参考答案:(1)逆 不变
(2)中 碱 NH4+
(3)①H2A 2H++A2-②3 ③C ④c(NH4+)>c(A2-)>c(H+)>c(OH-)
2H++A2-②3 ③C ④c(NH4+)>c(A2-)>c(H+)>c(OH-)
本题解析:(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,因为醋酸溶液中存在CH3COOH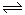 H++CH3COO-,则醋酸根离子浓度增大,平衡逆向移动;
H++CH3COO-,则醋酸根离子浓度增大,平衡逆向移动;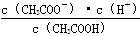 即为醋酸的电离常数,因为温度不变,所以电离常数不变;
即为醋酸的电离常数,因为温度不变,所以电离常数不变;
(2)醋酸与NH3·H2O的电离平衡常数相同,则铵根离子与醋酸根离子的水解程度相同,所以溶液呈中性;醋酸的酸性比碳酸强,所以碳酸氢根离子的水解程度大于醋酸根离子的水解程度也大于铵根离子的水解程度,碳酸氢根离子的水解使溶液呈碱性,所以碳酸氢铵溶液呈碱性;则NH4HCO3溶液中物质的量浓度最大的离子是NH4+;
(3)①99 ℃时,Kw=1.0×10-12,c(H+)=c(OH-)=10-6mol/L,因此pH=6的溶液为中性。则该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,所以H2A为二元强酸,完全电离,电离方程式为H2A 2H++A2-;
2H++A2-;
②该温度下,0.01 mol·L-1 H2A溶液中氢离子的物质的量浓度是0.02mol/L,稀释到20倍后,氢离子浓度变为0.02mol/L/20=0.001mol/L,溶液的pH=-lg0.001=3;
③体积相等、pH=1的盐酸与H2A溶液中氢离子的物质的量相等,则与足量的Zn反应时产生的氢气一样多,答案选C;
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,二者恰好完全反应生成(NH4)2A和水,铵根离子水解使溶液呈酸性,所以溶液中离子浓度的大小关系是c(NH4+)>c(A2-)>c(H+)>c(OH-)。
考点:考查电解质的电离平衡移动的判断,电离常数的判断,离子浓度的比较,电解质强弱的判断,盐的水解程度的比较,溶液酸碱性的判断
本题难度:困难
2、选择题 25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )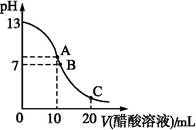
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
参考答案:A
本题解析:在A点是20 mL 0.1 mol·L-1 NaOH溶液和10 mL 0.2 mol·L-1醋酸溶液恰好反应完全,生成的醋酸钠中的醋酸根离子水解使溶液呈碱性,离子浓度的关系应该为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A项错误;B点时溶液为中性,c(OH-)=c(H+),由电荷守恒可得c(CH3COO-)=c(Na+),B项正确;在C点,CH3COOH过量,以CH3COOH电离为主,溶液呈酸性,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C项正确;在C点由物料守恒可得c(CH3COO-)+c(CH3COOH)=2c(Na+),故D项正确。
本题难度:一般
3、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
①在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
②在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
③向0.2mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
④常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
A.①④
B.②④
C.①③
D.②③
参考答案:B
本题解析:①HCO3-以水解为主,c(H2CO3) > c(CO32-);②是质子守恒;③混合溶液中,同浓度CO32-水解程度大于HCO3-,且生成HCO3-,c(HCO3-) > c(CO32-) ;④CH3COONa和CH3COOH混合溶液中,电荷守恒,c(CH3COO-) =c(Na+)=0.1 mol·L-1 >c(H+)=c(OH-),因此选B。
考点:主要考查盐类水解产物。
本题难度:困难
4、选择题 常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:B
本题解析:CH3COOH与NaOH的物质的量之比为2:1,设均为10L,则它们的物质的量分别为2mol和1mol,则混合后,溶液中的溶质为1mol的CH3COOH与1mol的CH3COONa,由于溶液的pH<7,即溶液以醋酸的电离为主,醋酸根离子的水解更弱;所以
A错,溶液中由水电离产生的H+浓度小于1×10-7 mol/L;B正确,c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L;C错,溶液中CH3COOH的电离程度大于CH3COONa的水解程度;D错,溶液中离子浓度的大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
本题难度:一般
5、选择题 某温度下,向一定体积的0.1mol/L醋酸溶液中逐滴加入0.1mol/LNaOH溶液,溶液中pOH【注:pOH=-lgc(OH-)】与pH的变化关系如图所示,则下列说法中正确的是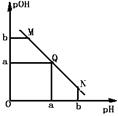
A.M点所示溶液中c(Na+)
参考答案:
本题解析:
本题难度:一般