时间:2017-08-22 15:04:43
1、选择题 某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是(?)
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+存在,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
参考答案:D
本题解析:加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色的现象是溶液中含有亚铁离子的特性,而氢氧化铁的红色沉淀比白色沉淀的颜色深得多,所以不可能存在。
本题难度:简单
2、选择题 将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是
A.H2SO4
B.C2H5OH
C.C6H6
D.CH3COOH
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (12分)实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: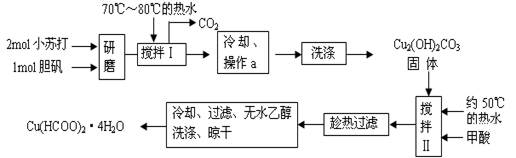
回答下列问题:
(1)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为?。
(2)操作a的名称是?,该操作使用的玻璃仪器有?。
(3)证明碱式碳酸铜沉淀已经洗涤充分的实验操作是?;“趁热过滤”的原因是?;
(4)用无水乙醇洗涤晶体的目的是?。
参考答案:⑴2Cu2+ + 4HCO3— = Cu2 (OH)2CO3 ↓ +3CO2? + H2O
⑵过滤?玻璃棒、漏斗、烧杯
⑶取最后滤出的洗涤液,无明显现象?防止甲酸铜结晶而损失
⑷除去甲酸并减少甲酸铜晶体损失(每空2分,共12分)
本题解析:略
本题难度:一般
4、选择题 将铝片投入硫酸铜溶液中,会出现下列现象:铝片表面立刻有紫红色物质沉积,同时产生较多气泡,继而产生蓝色沉淀,混合物温度升高甚至发烫,产生气泡速率明显加快,铝片上下翻滚,溶液中出现黑色物质……。对以上现象的说法错误的是(? )
A.铝片表面的紫红色沉积物为Cu ,离子方程式为2Al+3Cu2+=3Cu+2Al3+
B.生成的气体是H2,生成的蓝色沉淀为Cu(OH)2,产生该现象的离子方程式为3Cu2++6H2O+2Al=3Cu(OH)2↓+3H2↑+2Al3+
C.一段时间后反应速率明显加快的原因一定是;反应放热,使溶液温度升高,反应速率加快
D.溶液中出现的黑色物质可能是氧化铜
参考答案:C
本题解析:铝比铜活泼,和硫酸铜可发生置换反应生成铜,A正确。进而构成原电池,铝是负极加快反应速率,氢离子在正极放电,所以选项C是错误的。反应放热,有可能使氢氧化铜分解生成氧化铜,所以答案选C。
本题难度:一般
5、选择题 根据以下叙述制备氯化铜:先将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸。
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥9.6 | ≥6.4 |
参考答案:C
本题解析:当溶液达到Fe2+沉淀所需pH时,溶液中的Cu2+已经沉淀完全,无法分离;Cu与Fe2+不反应;由已知信息中FeS溶于酸知选项D错;故应先把Fe2+氧化成Fe3+,再调节pH使之沉淀,最后分离即可。
本题难度:一般