时间:2017-08-22 14:22:20
1、选择题 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )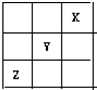
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.Y一定是非金属性很强的元素
D.1molX的单质跟足量水反应时,发生转移的电子为2mol
参考答案:由短周期元素在周期表中的位置可知,X最外层电子数为2,应为He元素,Y为F元素,Z为S元素,
A、Z为S元素,属于非金属元素,故A错误;
B、Y为F元素,无正价,没有对应的含氧酸,故B错误;
C、Y为F元素,在周期表中是非金属性最强的元素,故C正确;
D、X为He元素,性质稳定,不与水反应,故D错误.
故选C.
本题解析:
本题难度:一般
2、选择题 H2O与H2S结构相似,都是V形的极性分子,但是H2O的沸点是100 ℃,H2S的沸点是-60.7 ℃,引起这种差异的主要原因是(?)。
A.范德华力
B.共价键
C.氢键
D.相对分子质量
参考答案:C
本题解析:氧原子的电负性较大,水中的氧原子与氢原子可形成氢键,氢键使水的沸点反常的高,但硫的电负性相对较小,所以不会形成氢键,其沸点较低。
本题难度:一般
3、选择题 下列分子中,各原子均处于同一平面上的是
A.NH3
B.CCl4
C.H2O2
D.CH2O
参考答案:D
本题解析:氨气是三角锥形,四氯化碳是正四面体,H2O2是椅型结构,所以分子中所有的原子不可能处于同一平面内。甲醛是平面三角形结构,各原子均处于同一平面上,答案选D。
本题难度:简单
4、填空题 已知尿素的结构式为: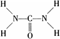 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)基态Fe3+的核外电子排布式为?;C、N、O三种元素的第一电离能由大到小的顺序是?。
(2)尿素分子中N原子的杂化方式是?。
(3)NH+4中H—N—H键角比NH3中H—N—H键角大,原因为?。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。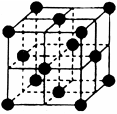
①1个CO2分子周围等距离且距离最近的CO2分子有?个。
②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为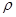 ?g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为?cm3
?g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为?cm3
参考答案:(8分)
(1)1s22s22p63s23p63d5(或[Ar] 3d5)(2分) N>O>C (2分)
(2)sp3(1分)
(3)NH3中N原子上有一对孤对电子,NH+ 4中N原子上无孤对电子,排斥力小(1分)
(4)①12(1分) ②23 4/(ρNA) (1分)
本题解析:
(1)基态Fe3+的核外电子排布式为1s22s22p63s23p63d5;同周期从左向右电负性增大N>O>C。
(2)N的价电子对为(5+3)/2=4,为sp3杂化。
(3)根据结构关系:NH3中N原子上有一对孤对电子,NH+ 4中N原子上无孤对电子,排斥力小。
(4)①可取此晶胞中面心的分子分析,在此晶胞中最近的8个,同理相邻晶胞中还有4个最近,共12个。②NaCl晶胞也为面心立方结构,每个晶胞中有4个Na和4个Cl,设有58.5g(1mol)NaCl,V=58.5g/ρ,晶胞数为NA/4,NaCl晶胞体积为V÷NA/4=234/(ρNA) cm3
本题难度:一般
5、选择题 下列物质中属于离子化合物的是( )
A.苛性钾
B.碘化氢
C.硫酸
D.醋酸
参考答案:A
本题解析:
本题难度:一般