时间:2017-08-22 14:22:20
1、选择题 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水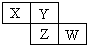
参考答案:B
本题解析:
本题难度:一般
2、填空题 【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol? I2 =" 1451" kJ/mol? I3 = 7733kJ/mol? I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
参考答案:(1)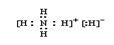 ?(2分)?(2)? 3?(1分),纺锤形(1分)
?(2分)?(2)? 3?(1分),纺锤形(1分)
(3)泡利不相容原理(1分)?(4)?第ⅦB(1分) d (1分),3d54s2(1分)
(5) sp3(1分),三角锥形(1分)(6)焰色反应(1分),?当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量。?(2分)?
(7)?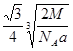 ?(2分)
?(2分)
本题解析:根据元素的性质、原子核外电子排布规律及元素在周期表中的位置可以判断,A是H,B是N,C是Mg,D是P,E是Cl,F是K,G是Mn。
(1)离子化合物中一定含有离子键,所以该化合物是由MH4+和H-形成的离子键,电子式为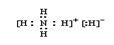 。
。
(2)N原子核外电子能量最高的是p电子,在空间有3个方向,原子轨道呈纺锤形。
(3)1个原子轨道最多容纳的电子是2个,且自旋方向相反,这就是泡利原理。3s轨道中的电子自旋方向相同,违反了泡利原理。
(4)Mn属于第四周期第ⅦB,Mn原子最后填入的电子是d轨道的,所以Mn属于d区。锰的原子核外有25个电子,所以就有25种运动方向。
(5)PCl3中中心原子的孤电子对数是1/2(5-3×
+
本题难度:一般
3、选择题 下列分子中属于非极性分子的是(?)
A.HF
B.H2O2
C.CO2
D.NH3
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列分子结构中的原子最外层电子都能满足8个电子稳定结构的是
[? ]
A.CH4
B.SF6
C.BF3
D.CCl4
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列物质中既有离子键又有共价键的是
[? ]
A、CaCl2?
B、H2O2?
C、KOH
D、H2S
参考答案:C
本题解析:
本题难度:简单