时间:2017-08-22 14:22:20
1、选择题 氧可与许多元素形成化合物,下列有关叙述错误的是( )
A.水分子的结构式为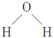
B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价
C.Na2O2的电子式为Na+[··············]2-Na+
D.在MgO晶体中,O2-的结构示意图可表示为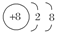
参考答案:B
本题解析:本题给出了不同粒子及化合物,要正确写出电子式,原子结构示意图、结构式、化合价等应首先确定粒子是原子还是离子、分子,是共价化合物还是离子化合物,这才是正确答题的关键。氧与氟形成的化合物(OF2)中,氧的非金属性比氟的弱,显正价。
本题难度:一般
2、选择题 下列分子中,属于含有极性键的非极性分子的是
[? ]
参考答案:D
本题解析:
本题难度:简单
3、填空题 (18分)下表中a、b、c…为周期表中部分元素,回答下列问
| a | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | f | y | h | i | ? |
| ? | b | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | e | ? | ? | ? | j | ? |
| c | ? | ? | ? | ? | ? | ? | d | ? | ? | ? | g | ? | l | ? | ? | ? | ? |
| ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
参考答案:
a
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
f
y
h
i
?
?
b
?
?
?
?
?
?
?
?
?
?
e
?
?
?
j
?
c
?
?
?
?
?
?
d
?
?
?
g
?
l
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?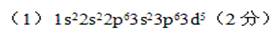
 ?两性:(2分)略
?两性:(2分)略
本题解析:(1)从图中可知,该表格有七行,即表示七个周期;有18列,即表示18个族。所以可以确定其边界应如图:
(2)从d的位置可知其为第四周期第8副族的元素,即铁元素。其原子的电子排布式应为:1s22s22p63s23p63d64s2。铁原子失去最外层的两个电子4s2时就是亚铁离子,在失去3d6中的一个电子,使d亚层达到半满状态。所以d3+的核外电子排布式为:1s22s22p63s23p63d5或[Ar]3d5
(3)从图中可知,y、h、i分别为F、N、O三种元素。
同一周期内元素的第一电离能在总体增大的趋势中有些曲折。当外围电子在能量相等的轨道上形成全空(p0, d0, fo)、半满(p3, d5, f7)或全满(p6, d10, f14)结构时,原子的能量较低,元素的第一电离能较大。所以三种元素的第一电离能由大到小的顺序为:F>N>O
(4)从图中可知:e元素为铝元素,其核外电子排布式为:1s22s22p63s23p1。所以其原子电子轨道表示式: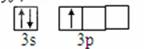
(5)根据元素周期表可知ya3应为NH3。所以其分子的电子式是: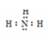
NH3分子的空间构型是:三角锥,中心原子N原子采取SP3杂化
(6)e元素为铝元素,其最高价氧化物对应的水化物为Al(OH)3,属于两性氢氧化物,离子方程式为:Al(OH)3+OH-=AlO2- +2H2O
本题难度:一般
4、选择题 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M如下图(组成E、G、L、M分子的元素原子序数均小于10),则下列判断错误的是(?)。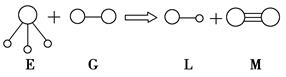
A.G是最活泼的非金属单质
B.L分子内的化学键是极性键
C.E能使紫色石蕊试液变蓝色
D.M化学性质活泼
参考答案:D
本题解析:本题不仅考查考生的观察能力,而且还有效考查了考生的思维应变能力和快速判断能力。在中学化学所学知识范围内,由原子序数均小于10的元素组成的空间结构呈三角锥形的分子应该是氨分子,结合题给信息不难推知,M应该为氮气分子,而氮气是一种非常稳定即化学性质较“惰”的气体质(因为N2分子中有一个三键:一个σ键,两个π键,三键键能很大)。根据题给图中球的大小不等可知,E、L为化合物,G、M为单质,结合组成E、G、L、M分子的元素原子序数均小于10的题给条件可大胆联想,E为氨气G为氟气,L为氟化氢,M为氮气,据此可以判断该反应为:NH3+F2―→HF+N2,本题应选D。
本题难度:一般
5、选择题 关于键长、键能和键角,下列说法不正确的是
[? ]
A.键角是确定多分子立体结构(分子形状)的重要参数
B.通过反应物和生成物分子中键能数据可以粗略预测反应热的大小
C.键长越长,键能越小,共价化合物越稳定
D.同种原子间形成的共价键键长长短总是遵循:三键<双键<单键
参考答案:C
本题解析:
本题难度:简单