时间:2017-08-22 14:14:47
1、选择题 下列表示的离子方程式正确的是(?)
A.NH NO
NO 溶液与氢氧化钠共热:
溶液与氢氧化钠共热:
H +OH-
+OH- H
H O
O
B.NH ·H
·H O滴入AlCl3溶液产生沉淀:
O滴入AlCl3溶液产生沉淀:
3OH +Al
+Al
 Al(OH)
Al(OH) ↓
↓
C.NaOH溶液与NaHCO 溶液混合:
溶液混合:
OH +H
+H
 H
H O
O
D.Al(OH) 固体溶于稀硫酸中:
固体溶于稀硫酸中:
Al(OH) +3H
+3H
 Al
Al +3H
+3H O
O
参考答案:D
本题解析:A中NH 与OH
与OH 共热可生成NH
共热可生成NH 。B中NH
。B中NH ·H
·H O是弱电解质,不能用OH
O是弱电解质,不能用OH 表示,应写化学式;Al(OH)
表示,应写化学式;Al(OH) 难溶于水,用化学式表示。C中HCO
难溶于水,用化学式表示。C中HCO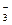 中的H
中的H 难电离,应写成HCO
难电离,应写成HCO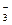 。
。
本题难度:一般
2、选择题 中和滴定开始后应注视:①滴定管内液面的变化 ②锥形瓶中溶液颜色的变化 ③滴定管溶液流出的速率
A.①和②
B.②和③
C.①和③
D.只有②
参考答案:B
本题解析:中和滴定开始和结束时,根据实验前和实验结束后的液面变化来测量药品用量。但是在中和滴定开始后,也就是滴定的过程中,应该注意的是锥形瓶中溶液颜色的变化以及滴定管溶液流出的速率,以便更好的控制中和滴定的进程。
点评:本题涉及了中和滴定实验,需要控制滴出液体的速率,快到滴定终点的时候,即锥形瓶中的开始有颜色变化时,要降低流速,这是关键。
本题难度:一般
3、选择题 下列说法正确的是( )
①pH=2和pH=1的HNO3中c(H+)之比为1∶10
②0.2 mol·L-1与0.1 mol·L-1醋酸中,c(H+)之比大于2∶1
③Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
④纯水在100 ℃和20 ℃时,pH前者大
⑤同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100 mL 0.1 mol·L-1的醋酸与10 mL 1.0 mol·L-1的醋酸中H+的数目,前者多
A.①④⑤
B.①⑤⑥
C.①②⑤
D.①②③⑥
参考答案:B
本题解析:略
本题难度:一般
4、选择题 我们的生活离不开能源。下列属于绿色能源的( )
A.天然气
B.太阳能
C.石油
D.煤
参考答案:B
本题解析:石油、煤、天然气均为化石能源。而太阳能无污染、环保,属绿色能源
本题难度:一般
5、选择题 水的电离过程为H2O H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,?KW(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,?KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃)
D.水的电离是吸热的过程
参考答案:D
本题解析:
水在电离的过程中温度升高,有利于水的电离,它是一个吸热过程。纯水中c(H+)和c(OH-)都增大,电离常数K及水的离子积都增大,但纯水中c(H+)=c(OH-),故选D。
本题难度:简单