时间:2017-08-22 14:14:47
1、判断题 在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
| 加入盐酸体积V/Ml | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/ ℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
参考答案:(1)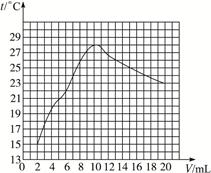
(2)①随盐酸量增加,中和反应放出热量增大,溶液温度上升
②过量盐酸起冷却降温作用,反应停止热量散失
(3)不合理,因为固体氢氧化钠溶于水也要放热
本题解析:用描点法将表格中的数据在图上表示出来,再连接成曲线。根据图象发现盐酸的量在2—10 mL时,随盐酸量增加,中和反应放出热量增大,溶液温度上升;当盐酸的量在10—20 mL之间,可能是盐酸已经过量,过量盐酸起冷却降温作用。不能用氢氧化钠固体,因为它在溶解过程中也会放热。
本题难度:简单
2、选择题 室温时,向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH溶液,溶液的pH变化曲线如下图所示。在滴定过程中,下列关于溶液中离子浓度大小关系的描述,不正确的是( )。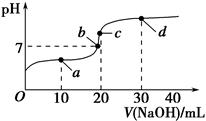
A.a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:AC
本题解析:a点相当于是CH3COOH与CH3COONa以物质的量1∶1混合的体系,溶液呈酸性,故c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),A错误;c点相当于是CH3COONa溶液,故存在质子守恒:c(OH-)=c(CH3COOH)+c(H+),C错误。
本题难度:一般
3、选择题 向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的CH3COOH溶液,其pH逐渐减小,图中a,b,c三点的pH为实验中所测得,下列有关说法中一定正确的是( )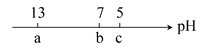
A.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.当pH=7时,所加CH3COOH溶液的体积为10 mL
C.当5<pH<7时,溶液中c(CH3COO-)>c(Na+)
D.继续滴加0.1 mol·L-1的CH3COOH溶液,溶液的pH最终可以变化至1
参考答案:C
本题解析:最初向NaOH溶液中滴加极少量的CH3COOH溶液时,可能有c(OH-)>c(CH3COO-),故A项错误;当滴加10 mL CH3COOH溶液时,与NaOH溶液恰好完全反应,此时pH>7,B项错误;无限滴加CH3COOH溶液,相当于在0.1 mol·L-1的CH3COOH溶液中滴加少量NaOH溶液,pH一定大于1,D项错误。
本题难度:一般
4、填空题 (6分)在25℃时,对于0. 1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中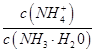 将?(填“增大”、 “减小”或“不变”);
将?(填“增大”、 “减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH ?7(填“大于”、“小于”或“等于”),用离子方程式表示其原因??,此时溶液中各离子浓度由大到小的顺序为?.
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1?V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式为??
参考答案:(1)增大(1分)
(2)小于(1分)?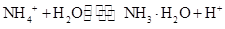
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(3)大于(1分)?c(NH4+)+c(H+)=2c(SO42-)+c(OH-)
本题解析:(1)氨水中存在着电离:NH3·H2O NH4++OH-,若向氨水中加入少量硫酸铵固体,则c(NH4+)增大,平衡向逆反应方向移动,此时溶液中
NH4++OH-,若向氨水中加入少量硫酸铵固体,则c(NH4+)增大,平衡向逆反应方向移动,此时溶液中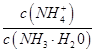 变大。
变大。
(2)混合后,溶液的溶质为(NH4)2SO4,存在NH4+的水解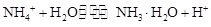 ,溶液显酸性;且其离子浓度大小关系为c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
,溶液显酸性;且其离子浓度大小关系为c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
(3)若二者的体积相等,则所得溶液溶质为(NH4)2SO4,显酸性;要使溶液则中性,则需硫酸的量较少。电荷守恒式为c(NH4+)+c(H+)=2c(SO42-)+c(OH-)。
点评:本题是对电解质溶液的综合考查。解题时,应首先判断溶液的溶质,其次根据电离水解,判断溶液中的离子种类以及溶液的酸碱性,最后再写出三个守恒式即可。
本题难度:一般
5、选择题 使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+1/2O2(g)=CO(g);ΔH=-Q1kJ/mol;CO(g)+1/2 O2(g)=CO2(g);ΔH=-Q2 kJ/mol。与这些焦炭完全燃烧相比较,损失的热量是( )
A.1/3Q1 kJ
B.1/3Q2 kJ
C.1/3(Q1+Q2) kJ
D.1/2Q2 kJ
参考答案:D
本题解析:18 g焦炭的物质的量为1.5 mol,其中有1/3生成CO,即0.5 mol C反应生成了CO气体,根据盖斯定律,知损失的热量为0.5 mol CO燃烧生成CO2所放出的热量,即0.5Q2,选D。
本题难度:一般