时间:2017-08-22 14:14:24
1、选择题 在约100 ℃的温度下,NaCl稀溶液中[H+]为1×10-6 mol·L-1。下列说法中正确的是(?)
A.该NaCl溶液显酸性
B.该NaCl溶液显中性
C.该NaCl溶液中?KW=1×10-14 mol2·L-2
D.该NaCl溶液中?KW=1×10-12 mol2·L-2
参考答案:BD
本题解析:在NaCl溶液中,Na+、Cl-对H2OH++OH-无影响。[H+]为1×10-6mol·L-1,[OH-]也为1×10-6mol·L-1。因此,该NaCl溶液显中性,KW=1×10-6mol·L-1×1×10-6mol·L-1=1×10-12mol2·L-2。
本题难度:简单
2、选择题 已知反应:
①25℃、101kP a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是 ( )
A.N2H4的燃烧热大于534 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量
参考答案:A
本题解析:1 mol N2H4在101 kPa 25℃时完全燃烧生成N2和液态水所放出的热量叫N2H4的燃烧热,现1 mol N2H4完全燃烧生成气态水放热534 kJ,易知N2H4的燃烧热大于534 kJ·mol-1,反应①的反应热△H =-534 kJ·mol-1,A对B错;稀H2SO4与稀NaOH溶液反应的中和热为57.3 kJ·mol-1不必加“-”,C错;CH3COOH是弱酸,其电离是吸热反应,故与NaOH溶液中和生成1 mol H2O时放出热量小于57.3 kJ。
本题难度:一般
3、计算题 (1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH=?;
(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH=?。
参考答案:(1)? 1? 13? (2)? 8
本题解析:(1)0.05mol/LH2SO4溶液中氢离子浓度为0.1mol/L,pH=1;25℃时0.05mol/LBa(OH)2溶液中氢氧根离子浓度为0.1mol/L,氢离子浓度为10-13mol/L,pH=13。
(2)100℃时,0.001 mol/L的NaOH溶液中氢氧根离子浓度为0.001mol/L,稀释到1L,氢氧根离子浓度为0.0001mol/L,氢离子浓度为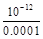 ?mol/L =10-8mol/L,pH=8。
?mol/L =10-8mol/L,pH=8。
点评:计算碱溶液pH时利用c(H+)= 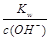 ,再求pH。
,再求pH。
本题难度:一般
4、选择题 在Na2S溶液中存在的下列关系不正确的是( )
A.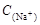 =2[
=2[ +
+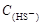 +
+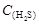 ]
]
B.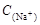 +
+ =
= +
+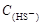 +
+
C. =
= +
+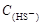 +2
+2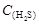
D.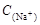 >
> >
> >
>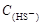
参考答案:B
本题解析:A符合物料守恒,正确。C符合质子守恒,正确。硫化钠水解显碱性,D正确。B不符合电荷守恒定律,是错误的,应该是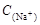 +
+ =
= +
+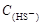 +2
+2 ,答案选B。
,答案选B。
本题难度:简单
5、选择题 甲溶液的pH=6,乙溶液的pH=2,则下列叙述正确的是
A.甲、乙两溶液的c(H+)之比为400︰1
B.甲、乙两溶液均呈酸性
C.甲中水的电离程度小于乙中水的电离程度
D.甲中水的电离程度与乙中水的电离程度无法比较
参考答案:D
本题解析:
正确答案:D
A.不正确,甲、乙两溶液的c(H+)之比为10-6︰10-2=1:10000?
B.不正确,pH=6,可能呈酸性,也可能呈中性;
C.不正确,甲中水的电离程度大于乙中水的电离程度,乙中酸性强,对水的电离抑制程度大。
D、正确,温度不定,水的电离常数不定。
本题难度:一般