时间:2017-08-22 14:05:07
1、填空题 (16分)物质在水溶液中可能存在电离平衡、盐的水解平衡
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
_________________
。
(3)NH3·H2O 的电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-) (填“增大”“减小”“不变”)。
(4)已知某温度下K(NH3·H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(5)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。
参考答案:(1)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(2)HCO3-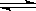 H+ +CO32- HCO3-+H2O
H+ +CO32- HCO3-+H2O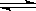 H2CO3+OH- H20
H2CO3+OH- H20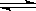 H+ +OH-
H+ +OH-
(3)NH3.H2O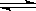 NH4+ + OH- 减小
NH4+ + OH- 减小
(4) 1.3×10-3
(5)<
本题解析:(1) (NH4)2SO4水解,溶液呈酸性,所以c(NH4+)>c(SO42-)>c(H+)>c(OH-);(2)NaHCO3溶液中,存在HCO3-的水解,HCO3-+H2O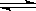 H2CO3+OH-;HCO3-的电离,)HCO3-
H2CO3+OH-;HCO3-的电离,)HCO3-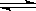 H+ +CO32-;水的电离H20
H+ +CO32-;水的电离H20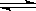 H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O
H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O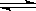 NH4+ + OH-;铵根离子浓度增大,NH3.H2O
NH4+ + OH-;铵根离子浓度增大,NH3.H2O NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以
NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以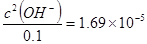 ,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。
,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。
考点:本题考查弱电解质电离和盐的水解。
本题难度:困难
2、选择题 下列方程式中是某种盐的水解方程式的是( )
A.HCO3-+H2O?CO32-+H3O+
B.Zn-2e-=Zn2+
C.NaHSO4=Na++H++SO42-
D.AlO2-+2H2O?Al(OH)3+OH-
参考答案:D
本题解析:
本题难度:简单
3、选择题 常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是:( )
A.三种酸的电离常数Ki(HX)> Ki(HY)> Ki(H2CO3)
B.结合H+的能力:Y->CO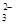 >X->HCO
>X->HCO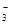
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:C(Na+)>c(HCO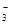 )>C(X-)>c(OH-)>c(H+)
)>C(X-)>c(OH-)>c(H+)
参考答案:B
本题解析:向NaX溶液中通CO2气体,只能生成HX和NaHCO3;则酸性H2CO3>HX> HCO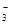 ;往NaY溶液中通入CO2则生成HY和Na2CO3。则酸性H2CO3 > HCO
;往NaY溶液中通入CO2则生成HY和Na2CO3。则酸性H2CO3 > HCO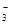 >HY;故酸性:则酸性H2CO3>HX> HCO
>HY;故酸性:则酸性H2CO3>HX> HCO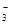 >HY; A.酸性越强,则在相同的温度下,酸的电离平衡常数就越大,所以三种酸的电离常数Ki(H2CO3) > Ki(HX)> Ki(HY) ,错误;B.酸越弱,则酸根离子结合H+的能力就越强,由于酸性:H2CO3>HX> HCO
>HY; A.酸性越强,则在相同的温度下,酸的电离平衡常数就越大,所以三种酸的电离常数Ki(H2CO3) > Ki(HX)> Ki(HY) ,错误;B.酸越弱,则酸根离子结合H+的能力就越强,由于酸性:H2CO3>HX> HCO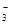 >HY;结合H+的能力:Y->CO
>HY;结合H+的能力:Y->CO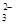 >X->HCO
>X->HCO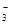 ,正确;C.弱酸的酸性越弱,则其形成的强碱的盐溶液水解程度就越大,溶液碱性就越强,所以溶液的碱性:: NaY>Na2CO3> NaX> NaHCO3,错误;D.NaX溶液中通入足量CO2后的离子浓度:会产生HX和NaHCO3;溶液显酸性,离子浓度:C(Na+)>c(HCO
,正确;C.弱酸的酸性越弱,则其形成的强碱的盐溶液水解程度就越大,溶液碱性就越强,所以溶液的碱性:: NaY>Na2CO3> NaX> NaHCO3,错误;D.NaX溶液中通入足量CO2后的离子浓度:会产生HX和NaHCO3;溶液显酸性,离子浓度:C(Na+)>c(HCO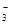 )>C(X-)>c(H+)>c(OH-),错误。
)>C(X-)>c(H+)>c(OH-),错误。
考点:考查弱酸的电离、盐的水解、溶液中离子浓度的大小比较的知识。
本题难度:困难
4、选择题 常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示。下列有关说法正确的是
A.a点溶液呈酸性,是因为HC2O4-的电离程度小于其水解程度
B.b点:c(K+)=c(H2C2O4-)+2c(C2O42-)
C.c点:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
D.d点:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
参考答案:B
本题解析:A.a点溶液二者恰好反应产生KHC2O4,溶液中同时存在HC2O4-的电离作用和水解作用,电离是溶液显酸性,水解使溶液显碱性。而a碘溶液呈酸性是因为HC2O4?的电离程度大于其水解程度,错误;B.b点时溶液是KHC2O4和K2C2O4的混合物。溶液呈中性,即有c(H+)=c(OH?),根据电荷守恒有c(K+)+c(H+)=c(HC2O4?)+2c(C2O42?)+c(OH?),故有c(K+)=c(HC2O4?)+2c(C2O42?),正确;c点是草酸与KOH恰好中和反应生成K2C2O4,根据物料守恒有c(K+)=2c(H2C2O4)+2c(HC2O4?)+2c(C2O42?),错误;D.d点是反应后得到的等物质的量的K2C2O4和KOH的混合液,由于C2O42?水解消耗,同时还产生OH?,应是c(OH?)>c(C2O42?),错误。
考点:考查酸碱混合溶液中离子浓度大小比较的知识。
本题难度:困难
5、选择题 下列实验不能达到预期目的的是:
| 序号 | 实验操作 | 实验目的 |
| A | 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 | 抑制Fe2+水解和防止Fe2+被氧化 |
| B | 将饱和FeCl3溶液滴入沸水中,溶液变红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大 | 比较S、C的非金属性强弱 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |
参考答案:C
本题解析:A. Fe2+有还原性,容易被空气中的氧气氧化为Fe3+,所以配制溶液时,应该加入少量的Fe粉;FeCl2是强酸弱碱盐,容易发生水解反应使溶液变浑浊,为了防止盐水解,应该向溶液中加入少量的稀盐酸,正确;B.盐的水解反应是吸热反应,升高温度会促进盐的水解,将饱和FeCl3溶液滴入沸水中,溶液变红褐色,正确;C.由于酸性H2SO3>H2CO3,酸的酸性越强,其相应的盐水解程度就越小,所以测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大,可以比较溶液的酸性强弱,但是由于S、C的非金属性强弱应该看元素的最高价的含氧酸的酸性强弱,H2SO3不是最高价的含氧酸,因此不能比较其非金属性强弱,错误;D.在充满NO2的密闭玻璃球中存在可能反应:2NO2 N2O4,该反应的正反应是放热反应,将充满NO2的密闭玻璃球浸泡在热水中,根据平衡移动原理:平衡向吸热反应方向移动,产生更多的NO2,因此可以用于研究温度对化学平衡移动的影响,正确。
N2O4,该反应的正反应是放热反应,将充满NO2的密闭玻璃球浸泡在热水中,根据平衡移动原理:平衡向吸热反应方向移动,产生更多的NO2,因此可以用于研究温度对化学平衡移动的影响,正确。
考点:考查化学实验操作即完成实验目的的关系的知识。
本题难度:一般