时间:2017-08-10 02:48:28
1、填空题 溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是______________,它是由______________键形成的_______________分子。
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为_______________________。
参考答案:(1)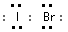 ;共价;极性分子
;共价;极性分子
(2)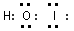
本题解析:
本题难度:一般
2、选择题 下列说法正确的是(?)?
A. C 、N、O的第一电离能依次增大?
B. NH3、H3O+、NH4+?均含有配位键
C. P4、 CCl4、 CH4 均为正四面体结构,键角均为109°28′
D.HClO?、 HClO3?、?HClO4的酸性依次增强
参考答案:D
本题解析:气态电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量叫做第一电离能,同周期元素自左向右第一电离能逐渐减小,A不正确。氨气中不存在配位键,B不正确。白磷分子中键角是60°,所以正确的答案是D。
本题难度:简单
3、选择题 下列有关金属键的叙述错误的是
[?]
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的物理性质和金属固体的形成都与金属键有关
参考答案:B
本题解析:
本题难度:简单
4、选择题 共价键、离子键和范德华力都是微粒之间的不同作用力,下列含有上述两种结合力的是?
[? ]
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷
A、①②④
B、①③⑥
C、②④⑥
D、③④⑤
参考答案:B
本题解析:
本题难度:简单
5、简答题 X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和.请回答下列问题:
(1)X、W的元素符号依次为______、______;
(2)写出Y2的电子式______;
(3)WZ2与XZ2分子的空间结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式);
(4)Q在元素周期表______区(填s、p、d、ds、f),其外围电子排布式为______,在形成化合物时它的最高化合价为______.
参考答案:X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,故L层有4个电子,故X为C元素;Z原子外围电子排布式为nsnnp2n,s能级最多容纳2个电子,故Z原子外围电子排布式为2s22p4,故Z为O元素;Y的原子序数介于C、O元素之间,故Y为N元素;W原子核外的M层中只有两对成对电子,则外围电子排布式为3s23p4,故W为S元素;Q的核电荷数是Z与W的核电荷数之和,故Q的核电荷数为8+16=24,为Cr元素.
(1)由上述分析可知,X为C元素,W为S元素.
故答案为:C;S.
(2)Y为N元素,氮气分子中N原子之间形成3对共用电子对,电子式为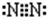 .
.
故答案为: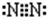 .
.
(3)WZ2为SO2,杂化轨道数为62=3,采取sp2杂化,含有1对孤对电子,故空间结构为V形;XZ2为CO2,杂化轨道数为42=2,采取sp杂化,没有对孤对电子,故空间结构为直线型;SO2是极性分子,CO2是非极性分子,水是极性分子,根据形似相溶原理,SO2在水中的溶解度较大.
故答案为:V形;直线型;SO2.
(4)Q的核电荷数为24,是Cr元素,处于周期表第四周期第ⅥB族,在元素周期表d区,其外围电子排布式为 3d54s1,在形成化合物时它的最高化合价为+6价.
故答案为:d;3d54s1;+6.
本题解析:
本题难度:一般